双载荷ADC — 差异性竞争的新热点
发布时间:
2024-09-28
作者:
刘文革 博士,中晟全肽研发战略部执行总监
引言
抗体-药物偶联物(antibody-drug conjugate, ADC)是单克隆抗体(antibody)通过linker将细胞毒性药物(载荷payload)利用抗体的靶向特异性递送到靶细胞,以提高抗肿瘤化疗药物的选择性,同时,ADC还保留抗体独有的(抗体介导,ADCC)抗肿瘤特性以及结合肿瘤环境释放的payload产生的旁观者效应,有效提高对肿瘤细胞的杀伤作用。
ADC在药物开发中取得了巨大成功,已有15款新药获批上市。目前,ADC药物研发空前火热,竞争异常激烈。尤其在第一三共上市了天花板级的ADC:T-DXD,夯实了ADC的抗肿瘤效果及其抗肿瘤机制,更激起了新一波的参与浪潮。此外,关于ADC开发的竞争点也日趋多样化,除了卷著名靶点(HER2, EGFR, Trop2 )外,新的差异性的竞争也不断涌现,比如双靶点ADC,新载荷药物,linker,Dar值的多少等等,尤其是最近出现的双载荷ADC概念更具特色。尽管ADC的技术经过了几次迭代,但许多单一有效载荷的ADC药物在临床研究试验中表现出剂量上不去和效果不及预期的现象。究其原因,很多研究认为是由于肿瘤组织的异质性,ADC药物的耐药性和毒素机制的差异性所导致。目前,有研究发现通过准确控制两种药物的比例,将两种协同有效载荷递送到癌细胞中,可以实现更有效的疗效。并且随着两种不同机制的有效载荷的应用,耐药性的发生率将显着降低。因此,基于不同毒素之间的作用机制互补性以开发提高协同药效的双载荷ADC药物,也许会成为下一代ADC药物研发的热点。
1、背景
ADC药物的本质就是改变载荷的分布,特异性地通过靶向机制(受体-抗原介导的细胞内吞)将多数毒性药物(payload)特异地递送到阳性表达的肿瘤组织。ADC开发的初衷是为了克服化疗药的耐药性和抗体单独使用的无效或失效。近年来ADC领域的快速发展和广泛应用为患者提供了新的治疗选择,但大多数肿瘤最终也会对这些药物产生耐药性。耐药性是系统性癌症化疗长期存在的问题。鉴于ADC的复杂性,人们总结了针对ADC不同成分的耐药机制,其中包括:涉及抗原表达减少、ADC转运和处理能力下降、细胞毒性有效载荷的抗药性以及药剂流出细胞的增加等机制。人们一直尝试用多种药物联合治疗的方法来降低耐药的概率或减缓耐药的速度。
几乎所有有效的癌症化疗方法都在利用互补药物组合,旨在尽量杀伤异质性肿瘤细胞群中的不同药物敏感细胞,达到消除肿瘤组织的最终目的。该策略最近也应用于ADC,可以通过使用相同的抗体递送替代弹头来克服对特定ADC的不敏感性。随着ADC药物在临床上的逐渐成功,以及ADC药物与免疫检查点抑制剂联合用药,大有取代化疗药物和免疫检查点抑制剂联合用药的趋势。目前已有许多全身性癌症化疗方案采用多种药物的组合,这些组合疗法可通过产生协同的抗癌效果以及延缓耐药细胞群的发展,从而改善治疗成果。
目前上市的ADC分子均采用了单一的毒性分子为payload,虽产生了一定的治疗效果,但仍有不足。以微管蛋白抑制剂MMAE为例,它的作用机制是通过抑制微管蛋白的聚合或者促进微管蛋白的聚合而干扰细胞的有丝分裂过程,使细胞有丝分裂中断,停滞于M期,从而导致处在快速分裂的肿瘤细胞发生凋亡,发挥抗肿瘤作用。因此,从作用机制上看,以MMAE为有效载荷的ADC对处于静息期的肿瘤细胞,效果较弱。同时,长期应用含MMAE的ADC,患者较容易产生耐药[1]。从生物学机制上来看,将两种乃至多种靶点的生物活性分子,同时连接在同一抗体上,得到多靶点ADC分子,可能会产生协同效应,从而进一步提升药物的抗肿瘤效果。例如,将微管蛋白抑制剂MMAE(或其衍生物)与拓扑异构酶抑制剂 (树碱衍生物)偶联至同一抗体得到多靶点ADC分子,那么在ADC到达肿瘤细胞后,同时释放两种生物活性分子,一方面中断细胞的有丝分裂,一方面抑制DNA的复制和转录,两者可能具有协同增效作用。
事实上,目前的化疗方案通常也会使用多种药物组合的方式。考虑到联合化疗的益处,使用具有两种或多种有效载荷的ADC或许可以避免ADC产生耐药性。双载荷ADC通过在一种抗体上偶联两种不同载荷或同一载荷的两种不同Linker,灵活调整DAR值,提高ADC活性,并降低耐药性发生率,实现耐药性克服和多机制协同的目标。这种创新策略可调整ADC的理化特性和毒性特征,扩展适应症范围,充分利用双载荷递送的优势。
2、双载荷ADC的发展和研发现状
虽然ADC在实体瘤和血液癌中被证明是成功的,但耐药性和肿瘤异质性仍是临床失败的主要原因。具有不同药物敏感性的异质性肿瘤会导致侵袭性肿瘤生长、高复发率和低生存率。为了应对这些挑战,大多数化疗方案都是由药物的组合。双载荷ADC可同时递送两种或多种小分子药物,产生添加或协同效应,提高治疗效果,还可以克服耐药性。鉴于肿瘤组织的异质性和耐药性,以及ADC药物中毒素机制的差异性,多载荷ADC模拟了化疗组合疗法,并增强靶向治疗的有效性,有可能逐渐成为双抗ADC后的下一代ADC药物研发的焦点。
目前的双载荷ADC药物采取不同机制设计,选择合适的荷载药物及其和抗体连接方式是双载荷ADC成功的关键。毒素的组合方式决定了作用机制和疗效。目前有相同的抗细胞分裂药物组合和抗细胞分裂与干扰DNA合成药物组合两种,均产生不同的疗效(见表一)。比如两种不同的高效 auristatin 分子具有互补的理化特性的偶联提供了一种增强异质细胞群对 ADC 活性的敏感途径。常用的 auristatin 药物接头包括 mc-MMAF 和 mc-vc-MMAE。mc-vc-MMAE 药物接头释放的药物MMAE具有细胞渗透性,并表现出旁观者活性或杀死邻近抗原阴性细胞。然而,MMAE 也是 MDR外排的底物,所以在MDR泵高表达的肿瘤细胞上的抗肿瘤活性降低。相反,分别从 mc-vc-MMAF 和 mc-MMAF ADC 释放的 MMAF不会被外排(非MDR底物),所以在 MDR(+) 细胞上保持活性,但细胞渗透性最低。结合这些类型药物可以对癌症提供互补活性的特性,从而开发出具有增强细胞毒性特征的 ADC药物。
表一 Summary of multi-payload ADCs
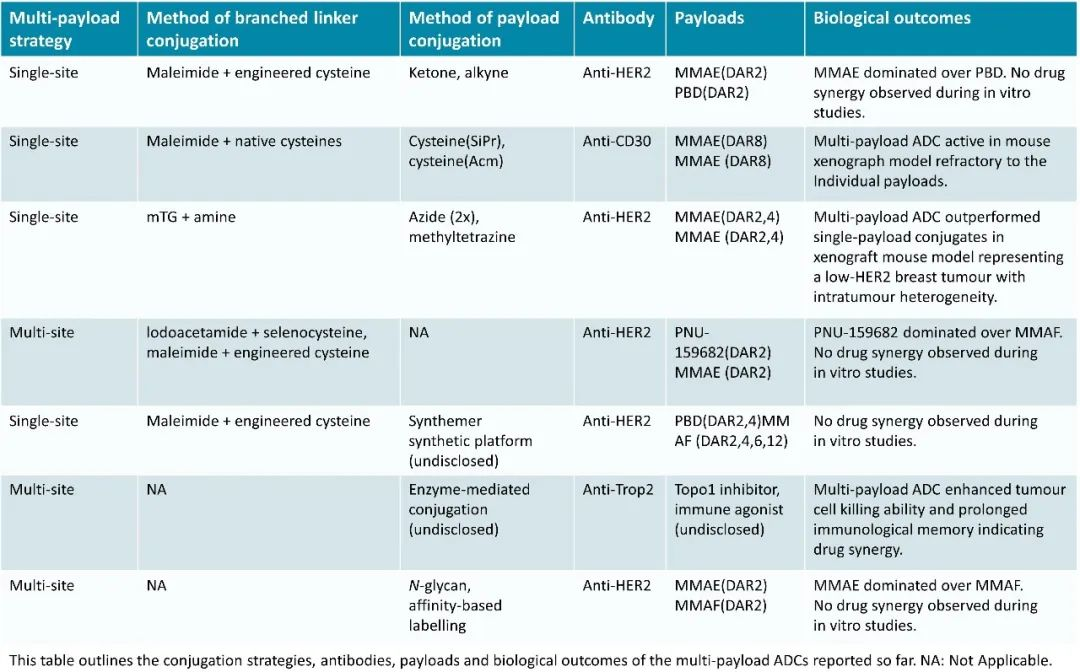
目前,用于构建双载荷ADC的方法还是主要集中于第二代偶联技术:工程化的反应性半胱氨酸残基、链间二硫键重塑技术、非天然氨基酸介导的点击化学、酶辅助连接、糖型重塑和糖缀合等[2]。双载荷ADC目前主要的构建方法是:①在抗体的同一位点引入分支linker,再通过点击化学反应引入有效载荷;②在抗体的不同位点引入单链linker和有效载荷。定点和均质偶联技术也是双毒素ADC开发成功的关键技术。
一个linker(一个抗体结合位点)接两个或多个药以及多个linker(各自抗体结合)接多个药物,这两种策略都有各自的优点和缺点,最终的选择取决于有效载荷类型、不同的有效载荷数量、所需的DAR和抗体特性(见图一)[3]。利用正交保护的顺序活化半胱氨酸残基,使其与每种药物的位点特异性偶联。此外,利用天然抗体半胱氨酸残基的偶联,使这种正交顺序活化偶联方法具有广泛的适用性,并且能够实现高载药量以提高ADC效力。为了突出ADC双载荷传递的优势,该策略被应用于制备含有两类具有不同理化性质荷载药物的ADC,并发挥其互补抗癌效果。
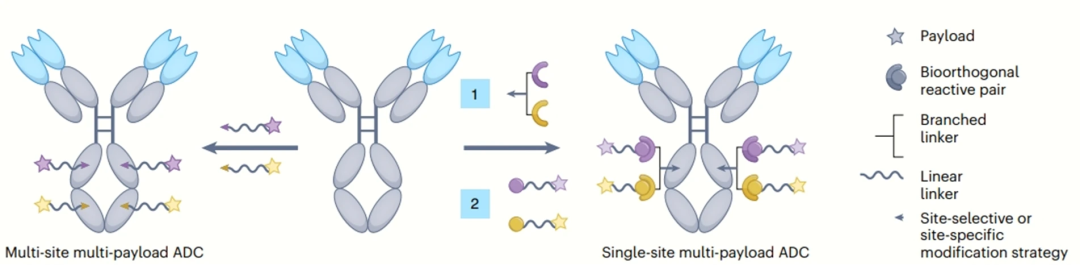
图一 多载荷 ADC 的构建方法
随着 ADC 治疗耐药性的出现,用一种抗体与两种甚至多种不同的细胞毒性有效载荷,研究开发下一代 ADC提供了一个有吸引力的选择。为了证明双载荷ADC可行性和有效性,Levengood等人[4]于2017 年制备了一类包含两种不同微管蛋白聚合抑制剂的ADC。该团队将具有不同物理和化学性质的MMAE和MMAF与CD30抗体偶联,以发挥互补的抗癌活性。在单药耐药的间变性大细胞淋巴瘤异种移植模型中表现出显著的治疗效果。如图二所示,双毒素(cACh10-(2-3))比任何一个单独药物ADC,cACh10-2或cACh10-3抗肿瘤效果明显提高。虽然这两种有效载荷都靶向微管,但它们的作用机制和结合位点是不同的。这些结果表明,使用两种靶向微管但具有不同作用机制的有效载荷,可以潜在地克服因细胞异质(多种细胞周期状态)产生的治疗抗性和肿瘤复发,并为下一代ADC的双载荷偶联研发开了先河。
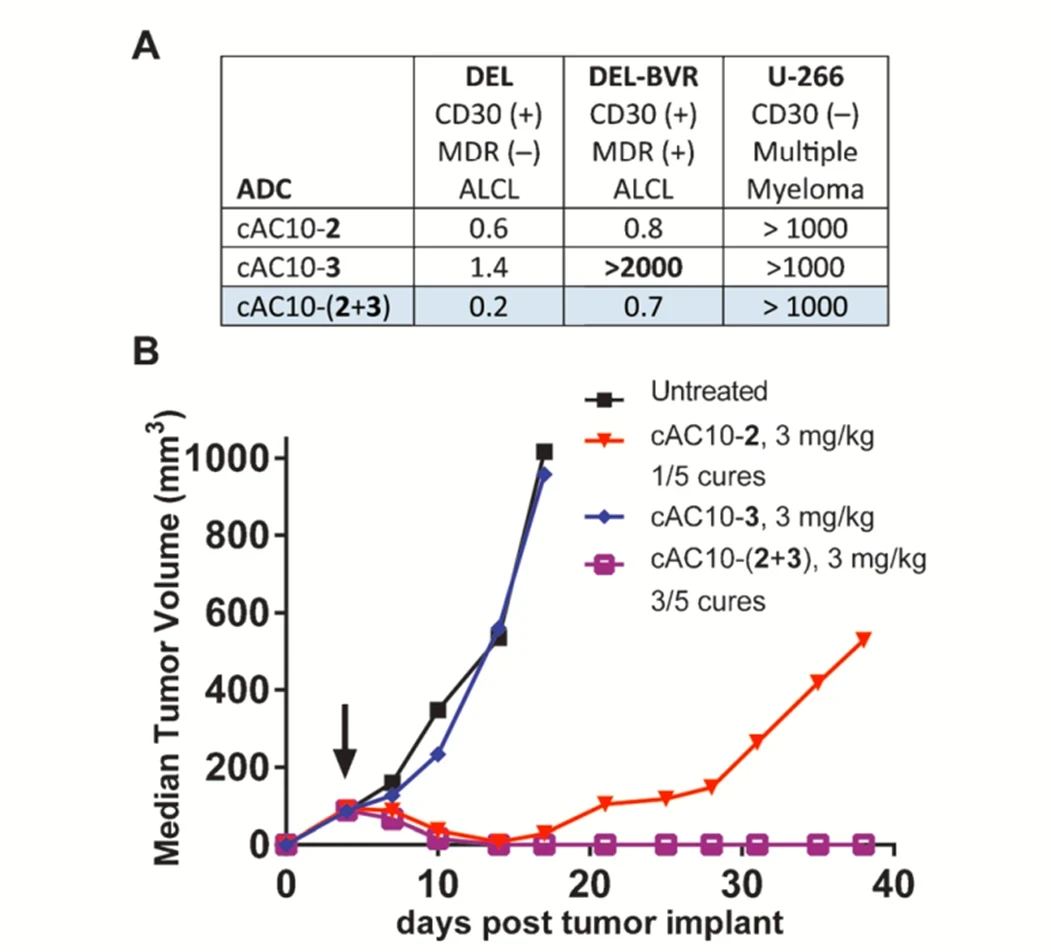
图二 双毒素ADC对MDR(+)间变性大细胞淋巴瘤细胞的体外活性(A)和体内(B)研究
通过依次偶联有效载荷在半胱氨酸残基上,以总共16的DAR值将 MMAE 和 MMAF与抗CD30抗体均匀偶联(每个抗体8个 MMAE 和8个 MMAF 分子)。MMAE是多药耐药 (MDR) 转运蛋白的底物,通常对 MDR(+) 肿瘤细胞的活性降低。然而,这种毒素的疏水性使其更易进入细胞内,以此预示了该双载荷ADC的潜力。但是半胱氨酸烷基化的均相偶联依赖于利用单克隆抗体内的所有8个链间衍生的半胱氨酸残基,从而产生具有16的固定DAR的ADC(每药8个)。这种固定的连接方式是不能随意调整 DAR值,也因此使低 DAR 值的ADC 的产量受到限制。
为了解决这个问题,Kyoji Tsuchikama[5, 6] 通过化学酶连接法高效构建了一系列具有明确药物抗体比 (DAR) 的双载荷ADC(DAR 组合分别为 2+2、4+2 和 2+4),DAR调整的灵活性有利于根据疾病靶点和有效载荷组合对 ADC的理化性质、功效和毒性进行微调(图三)。其中,DAR 为(4+2)的 MMAE/MMAF 双有效载荷ADC比 DAR 为4或6的MMAE单药 ADC 更有效,并且在治疗剂量下具有特异性的HER2细胞杀伤能力、理想的药代动力学特性、最小的炎症反应和边际毒性。此外,在JIM·T-1/MDA-MB-231 混合异种移植物的小鼠模型中,HER2表达的异质性和对 TDM1 耐药性增加,双载荷ADC比两种单药联合具有更大的治疗效果和生存获益。原因可能是较强的 MMAF 分子杀死了 JIMT-1 细胞,帮助同行的 MMAE 分子有效地对邻近的 MDA-MB-231 细胞产生旁观者效应。重要的是,这种显著的疗效不能单独通过 MMAF ADC 和 MMAE ADC 的 1:1 组合来实现。双载荷ADC的增强疗效也在另一种HER-2低表达的肿瘤和 T-DM2耐药性的乳腺癌异种移植小鼠模型中得到证明。结果证实双载荷ADC具有克服乳腺癌异质性和耐药性的潜力,表明同时递送具有不同药物特性的两种有效载荷是一种很有前途的方法,可用于基于ADC治疗的其他具有异质性和耐药性的难治性癌症。
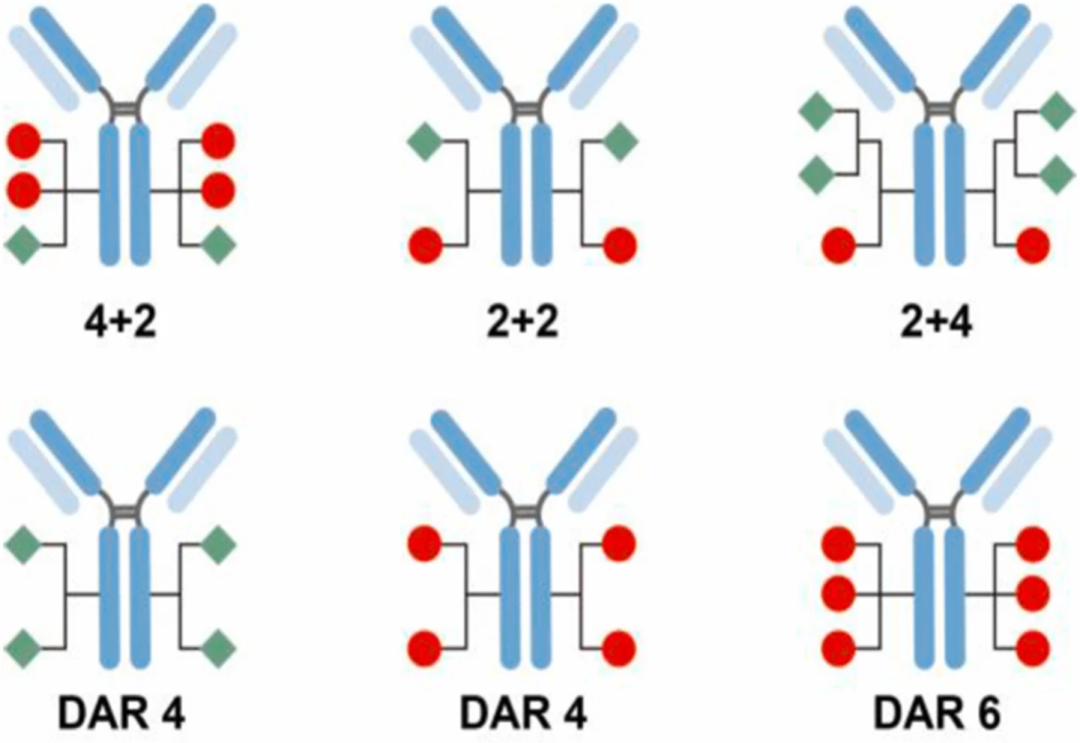
图三 双载荷药物ADC的模式图(红色和绿色形状表示不同的载荷)
除了MMAE和MMAF联合有效载荷的ADC外,也在探索结合两种不同有效载荷类别的双载荷ADC的临床潜力。ADC药物能够同时递送具有不同抗癌机制的多种治疗药物,从而克服耐药性,并产生附加或协同抗癌作用,以此提高抗肿瘤疗效。Kumar等人报道了另一种双载荷ADC,其中含有两种具有不同细胞靶点的药物,MMAE和一种吡咯苯二氮卓(PBD)二聚体。在研究中,利用一个三功能连接子,允许两种药物偶联到抗体上的相同位点。具体来说,该linker包含一个自稳定的N-芳基马来酰亚胺,用于与抗体上的工程硫醇进行位点特异性的结合。总的来说,这种策略需要对抗体进行三个合成步骤,每个步骤后都进行纯化。如图四所示,与单个药物对照组相比,在表达HER2的MDA-MB-453细胞中双载荷ADC有明显的体外抗肿瘤效果,表明PBD药物的较高效价主导了ADC的作用[7]。
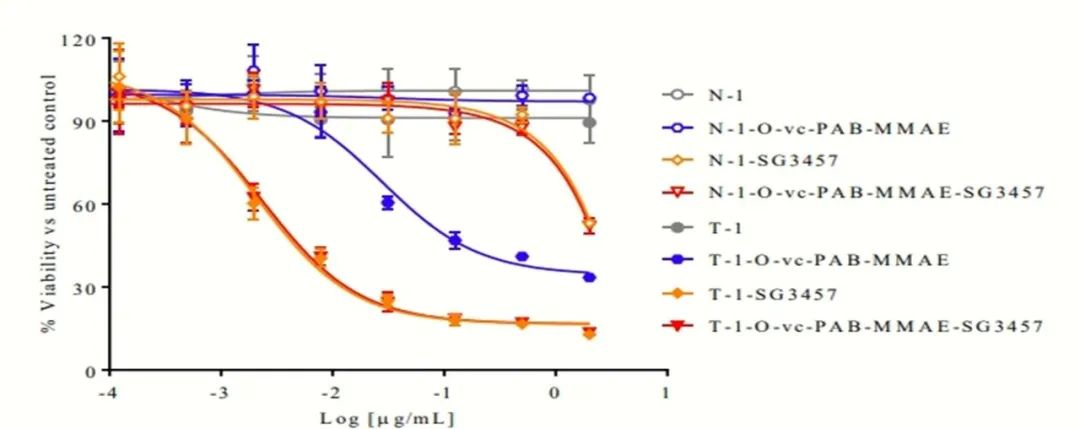
图四 比较单药和双载荷偶联物在HER2高表达的乳腺癌细胞系MDA-MB-453的体外细胞毒性
然而,并非所有双载荷ADC的研究都证明了协同效应,特别是那些涉及不同有效载荷类别的研究。例如,一种配备MMAE + SG3457的抗HER2 ADC,这是一种能够通过交联破坏DNA的超高效PBD二聚体,DAR为2+2 。同样,另一种靶向HER2的ADC也被开发出来,该ADC配备了MMAF和高效拓扑异构酶II抑制剂PNU-15968, DAR也为2+2。尽管这两种ADC都有望发挥协同作用机制,但这两种药物都没有发现比单药ADC更有效[5]。这些发现强调,选择有效载荷与适当的机制配合的重要性,确保所选两种有效载荷之间的平衡效力,优化DAR值以达到最佳治疗效果。
3、结论和挑战
双载荷ADC是继双抗ADC后以增加抗肿瘤疗效和抵抗耐药的另一新兴研究方向,尽管这项研究还处于药物开发早期,但随着该项研究的科学验证和方法的进步,一种新型ADC终将会诞生。目前双载荷ADC有同一位点和不同位点两种构建方式,从目前的一些研究结果来看,双载荷ADC可以根据治疗目的灵活调整DAR,使其具有不同的疗效,在某些肿瘤类型中(如异质性,耐药)表现出更好的抗肿瘤疗效,但双载荷ADC真正应用于肿瘤治疗仍然任重道远。
目前已有的研究发现,双载荷ADC体内的疗效甚至比体外观察到的更明显,表明了在复杂肿瘤环境中评估双载荷ADC尤为重要。但是,两种生物活性分子因作用机制不同、生物活性各异、药代性质差别,其起效剂量、毒性剂量均有不同,采用简单的1:1的比例与抗体偶联形成的ADC,难以保证分子有效且安全(例如一个毒素已经达到毒性剂量,另一个毒素还未达到有效剂量;或者一个毒素达到有效剂量,另一个毒素已远远超过最大耐受剂量),成药的可能性较低。通过何种方式控制ADC中两种不同生物活性分子的比例,才能在保证ADC在安全的前提下,对肿瘤细胞产生最佳的治疗效果,尚需要进一步研究和开发。
抗肿瘤药物的有效性和持久性的目标达成,还必须克服耐用性和肿瘤组织的异质性。而联合给药,多种治疗方法协同和个体医疗(针对不同阶段和不同病情个性化治疗)是目前可用方案。化疗药的联合用药已取得不小的成果,在此基础上的ADC药物联合,最终一靶多药的ADC或PDC的开发,将会拓展一个抗肿瘤治疗的新领域。
参考文献
- 1. Abelman, R.O., et al., Mechanisms of Resistance to Antibody-Drug Conjugates. Cancers (Basel), 2023. 15(4).
- 2. Walsh, S.J., et al., Site-selective modification strategies in antibody-drug conjugates. Chem Soc Rev, 2021. 50(2): p. 1305-1353.
- 3. Journeaux, T. and G. Bernardes, Homogeneous multi-payload antibody-drug conjugates. Nat Chem, 2024. 16(6): p. 854-870.
- 4. Levengood, M.R., et al., Orthogonal Cysteine Protection Enables Homogeneous Multi-Drug Antibody-Drug Conjugates. Angew Chem Int Ed Engl, 2017. 56(3): p. 733-737.
- 5. Tsuchikama, K., et al., Exploring the next generation of antibody-drug conjugates. Nat Rev Clin Oncol, 2024. 21(3): p. 203-223.
- 6. Yamazaki, C.M., et al., Antibody-drug conjugates with dual payloads for combating breast tumor heterogeneity and drug resistance. Nat Commun, 2021. 12(1): p. 3528.
- 7. Kumar, A., et al., Synthesis of a heterotrifunctional linker for the site-specific preparation of antibody-drug conjugates with two distinct warheads. Bioorg Med Chem Lett, 2018. 28(23-24): p. 3617-3621.
*声明:本文仅是介绍医药疾病领域研究进展或简述研究概况或分享医药相关讯息,并非也不会进行治疗或诊断方案推荐,也不对相关投资构成任何建议。



