自身免疫疾病治疗新策略:口服多肽药物研发进展与挑战
发布时间:
2025-05-14
作者:
王斌 博士,中晟全肽研发战略部高级科学家
1、多肽类药物的口服递送及其迭代
多肽药物作为介于小分子药物和大分子蛋白药物之间的特殊类别,因其在靶点选择上的优势以及较低的免疫原性,近年来引起了广泛关注。然而,现有多肽疗法多依赖注射,口服递送成为关键突破方向,但其面临低生物利用度(胃肠酶降解、上皮渗透性差)与稳定性不足的核心挑战。为应对这些挑战,技术创新不断涌现。一方面,可使用肠溶包衣或pH调节添加剂改善胃酸导致的降解,还可利用添加剂使胃蛋白酶或小肠肽酶失活;另一方面,提高渗透性也是重要研究方向,包括使用吸收促进剂、进行结构修饰、增强跨细胞转运等。
已上市的口服多肽药物为研发提供了宝贵经验(表1)。第一个代表性的例子是首个成功上市的口服多肽药物环孢素。环孢素是一种免疫抑制药物,主要用于预防器官移植患者的排斥反应,现阶段也用于治疗类风湿性关节炎和银屑病等自身免疫性疾病。其是一种由11个氨基酸组成的多肽。一般情况下的多肽和蛋白类药物在水中溶解度很高,但环孢素独特的环状构象使其具有亲脂性且在水中溶解度较差。口服型环孢素借助SNEDDS形成微乳(玉米油/乙醇载体),生物利用度达25-30%,肾移植患者可达89%[1]。但其天然环状疏水结构及构象稳定性使其成为独特高吸收模型,机制难以复刻至合成多肽。
表1. 已上市的口服多肽药物,以及其多肽口服递送技术及口服利用度[2,1]
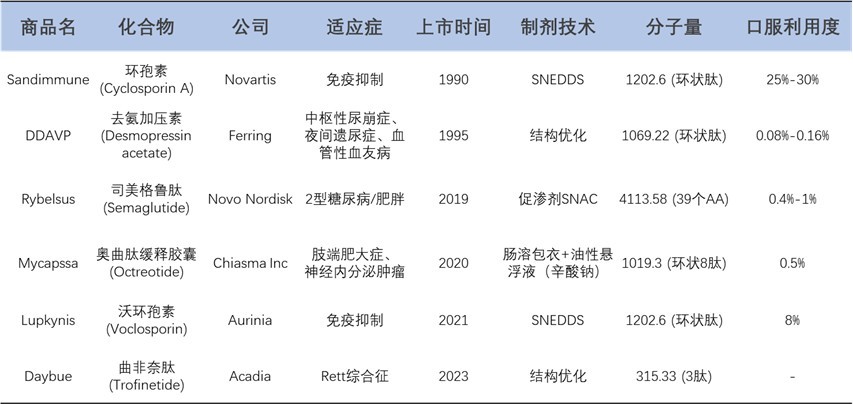
去氨加压素(Desmopressin)是由Ferring Pharmaceuticals公司开发,其产品DDAVP®以口服剂的形式在1995得到批准上市,用于尿崩症的治疗。去氨加压素是激素肽加压素(vasopressin)的肽类似物(图1),它比加压素更能抵抗酶降解。在体内吸收方面,去氨加压素的亲水性环状肽依赖细胞旁路吸收,生物利用度仅0.08-1%[3],但凭借超高靶标亲和力(纳摩尔级活性)实现低剂量有效。多肽药物的活性和选择性足够高,在稳定性的保障下,即便很低的口服生物利用度,也有可能成为口服制剂的选择。
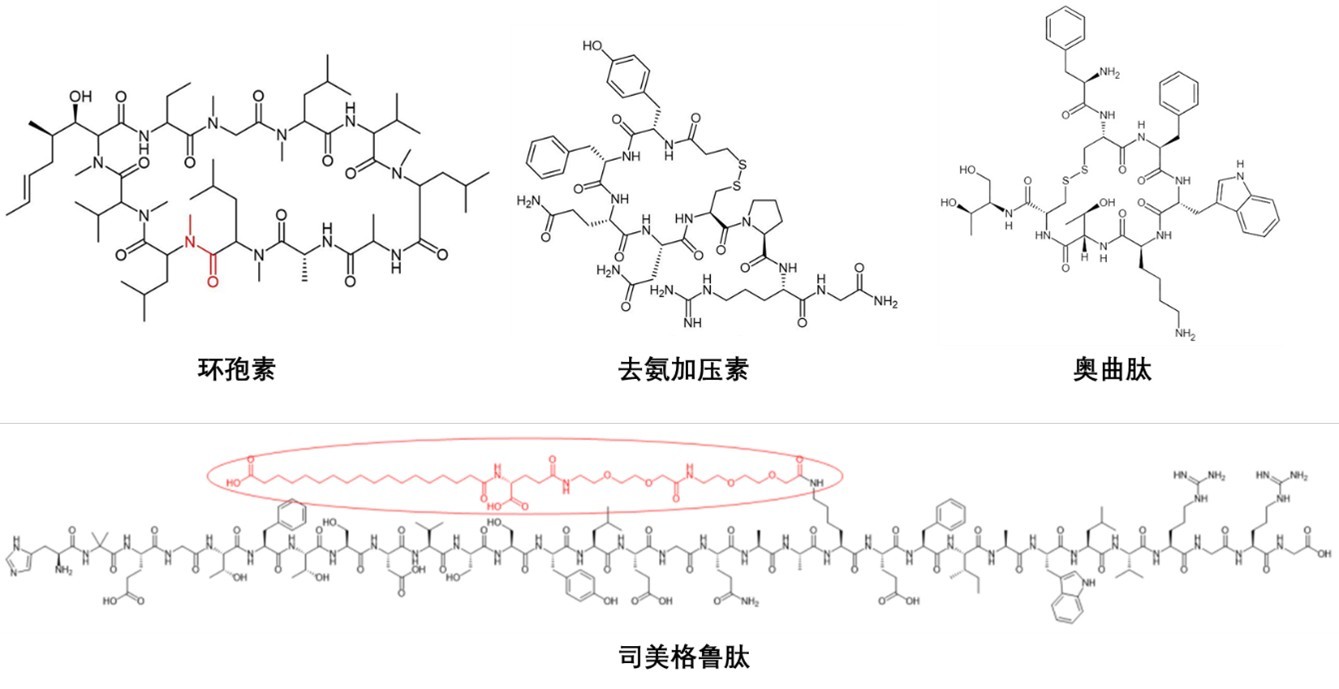
图1. 主要口服多肽药物分子结构式
奥曲肽是一种合成环八肽,用于治疗肢端肥大症。1988年诺华推出其长效注射剂,2020年以色列Chiasma公司通过开发出首个口服胶囊Mycapssa,突破多肽口服递送瓶颈。该药利用奥曲肽的环状结构及掺入非天然氨基酸赋予的消化道稳定性(胃液中120分钟降解<10%);其口服剂型方面,关键创新采用肠溶胶囊与油性悬浮液配方,延缓降解并防止聚集;其含有的辛酸钠成分,结合油相保护,增强肠道通透性。然而,该药物的Ⅰ期试验显示口服20mg生物利用度仅0.5%(等效皮下注射0.1mg)[2],显著低于临床前动物数据,反映种属差异对吸收机制的影响。此案例凸显多肽口服开发中剂型设计与生物屏障协同突破的复杂性。
近年来备受瞩目的司美格鲁肽是口服多肽制剂的成功典范,其独特的脂化修饰技术为多肽口服制剂打开了一扇广阔的大门。它通过结构修饰(Aib取代防DPP-4降解,C18脂肪链延长半衰期)和SNAC促渗(300mg/片SNAC通过多种作用实现0.4-1%生物利用度)取得双重突破[4]。但该口服制剂也存在个体差异大、需严格空腹服药且饮水量受限等问题,影响临床依从性和实际疗效。针对多肽类药品的口服研发需从其本身性质出发进行优化,确保药物在低剂量即可发挥治疗效果,同时具备胃肠道稳定性,拥有较长的半衰期和宽广的治疗窗,这是开发此类药品的基础。
2、自免口服(多肽)药物的新进展
自身免疫性疾病(Autoimmune Diseases)是一类由于机体免疫系统错误地攻击自身组织和器官而导致的疾病,涵盖了如银屑病、炎症性肠病(IBD)等多种病症。过去几十年,以细胞因子或介素为代表靶点的自免药物开发,是全球药物成功率较高的领域之一。随着自免领域市场份额不断攀升至2000亿美金的规模,竞争也日益激烈[5]。传统的免疫抑制剂和抗体药物(尤其是生物制剂)虽然在疗效上表现出色,但存在给药不便、免疫原性高、组织渗透性差、生产成本高等诸多局限性。例如,英夫利西单抗、乌司奴单抗等需要通过静脉注射或皮下给药,不仅患者依从性差,且全身暴露带来感染和恶性肿瘤风险增加。临床数据显示,抗IL-23单抗Stelara在中重度IBD患者中仅30%达到临床缓解,约20%初始应答者因抗药抗体产生而失去响应[6,7]。此外,抗体药物复杂的生产工艺(哺乳动物细胞表达、严格纯化要求)和冷链物流需求导致治疗成本居高不下。
近年来,自免治疗药物领域的竞争格局正在被重塑。与注射型生物制剂相比,口服药物(小分子和多肽)具有以下优势:1)更高的患者依从性:口服给药更方便,减少了患者对治疗的抵触情绪,从而提高依从性。2)更佳的安全性:通过在肠道炎症部位提供局部组合疗法,尽量减少全身暴露,降低了全身性免疫抑制带来的风险。3)更低的生产成本。在这样的背景下,笔者将围绕口服多肽药物的研发进展,重点关注自免靶点,特别是近期进展的IL-17、IL-23、TYK2、TNF受体和α4β7整合素等靶点的相关药物,旨在为自免口服多肽药物的研发提供参考。
2.1 IL-23及口服多肽药物:JNJ-77242113的突破性进展
IL-23/IL-17信号轴是驱动多种自身免疫性疾病(尤其是银屑病和IBD)发病的关键通路。IL-23主要由抗原呈递细胞产生,通过与Th17细胞上的IL-23受体结合,促进IL-17的产生,从而加剧炎症反应。IL-23和IL-17已被证实是治疗IBD和银屑病等自免疾病的有效靶点。尽管有抗IL-23单抗,如乌司奴单抗在临床上取得一定疗效,但其瓶颈仍是依从性和生产成本。JNJ-77242113(icotrokinra)是一种工程化环肽分子,由强生公司和Protagonist Therapeutics利用其专有的多肽发现平台开发,为全球首个口服IL-23通路抑制剂,用于治疗中重度斑块状银屑病[8,9]。
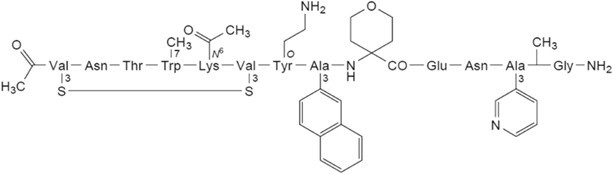
图2. JNJ-77242113多肽分子结构[9]
JNJ-77242113的初始分子是通过噬菌体展示筛选的方法得到的多肽,然后通过药化引入非天然氨基酸及侧链修饰以提高稳定性及口服利用度,如此反复多轮获得具有高生物活性及良好成药性的环肽PTG-200,其多肽分子结构见图2。JNJ-77242113与IL-23R的亲和力也达到了抗体级别(KD:7.1pM, 图3)。此外,JNJ-77242113的半衰期也被延长至9-16小时,有助于增强其系统性活性(图4)[8,9]。值得一提的是,在大鼠口服给药后的药代动力学及组织分布研究中,JNJ-77242113表现出低口服生物利用度,但可检测到血浆浓度,且在肠道组织、黏液、黏膜及结肠粪便中的药物暴露量显著升高。这一分布特征提示其可能通过局部肠道作用发挥疗效,而非依赖全身循环。
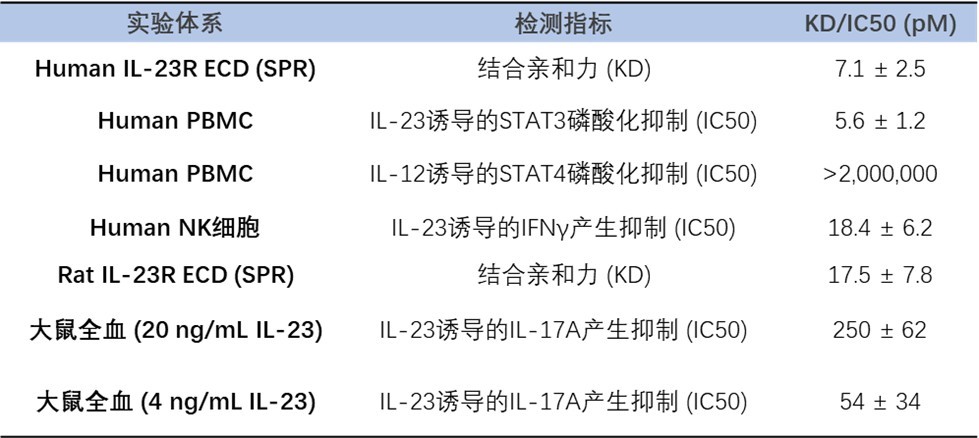
图3. JNJ-77242113对IL-23R结合亲和力及细胞中IL-23介导反应的抑制效力[9]
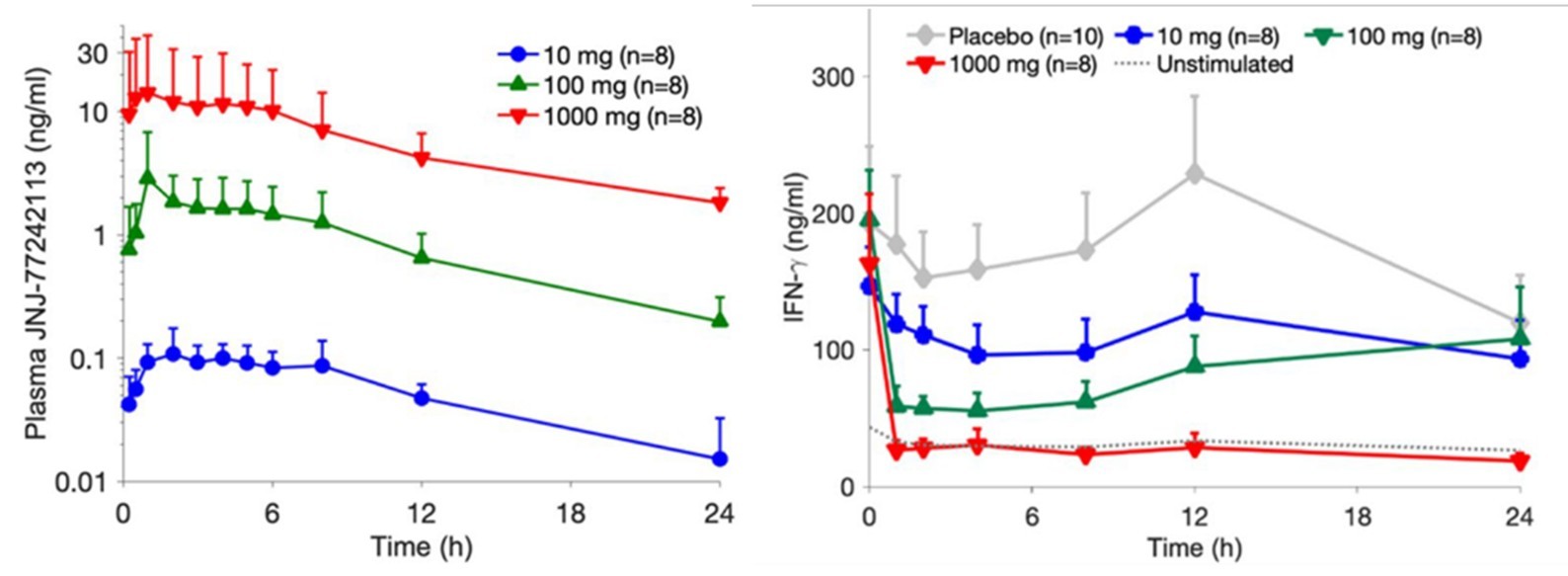
图4. JNJ-77242113在健康受试者首次人体研究中的口服药代动力学与药效学[9]
在关键IIb期FRONTIER 1针对银屑病患者临床研究中,JNJ-77242113展现出瞩目的临床效果,剂量依赖性疗效:100mg每日两次组16周时PASI (Psoriasis Area and Severity Index) 75应答率达76%,显著高于安慰剂组,41%患者达到完全皮肤清除(PASI 100)。对头皮、指甲等传统治疗抵抗部位同样有效。安全性方面,JNJ-77242113表现出良好的耐受性,最常见不良事件为轻度感染,无严重感染或恶性肿瘤报告[10]。
在III期关键性研究 (ICONIC-LEAD) 中,每日一次口服JNJ-77242113在治疗12岁及以上中重度斑块状银屑病患者中表现出显著的皮肤清除率和良好的安全性[11]。并在所有关键次要终点上显著优于口服TYK2 (Tyrosine Kinase 2) 抑制剂氘可来昔替尼(Deucravacitinib)。氘可来昔替尼是此前十余年首个获批用于中重度银屑病的口服创新疗法。强生计划启动首个头对头研究ICONIC-ASCEND,旨在证明口服的JNJ-77242113相对于注射用生物制剂乌司奴单抗(Stelara, 抗IL-12/23)的优效性。若获得成功,则是是衡量口服多肽药物能否真正挑战甚至超越现有注射型生物制剂标准的关键一步。
从市场竞争角度看,JNJ-77242113有望填补口服高效药物的市场空白。目前口服JAK抑制剂(如氘可来昔替尼)因安全性警告使用受限,而JNJ-77242113在关键III期ICONIC-ADVANCE研究中已显示优于氘可来昔替尼的疗效。若获批,该药物可能重新定义轻中度银屑病治疗标准,并分流部分传统生物制剂市场。
3、处于临床研究中的口服自免靶点及药物
除了靶向IL-23R的口服多肽JNJ-77242113外,还有多个靶点和其他类型的口服药物(主要是小分子抑制剂)在自身免疫性疾病领域积极开发中,它们共同构成了下一代口服自免疗法的竞争版图 (表2),下面对几个重要的靶点及药物研发进展进行简要介绍。
表2. 进入临床试验的自免口服靶点及药物
3.1 DC-806药物及IL-17靶点
IL-17信号通路在银屑病、银屑病关节炎和强直性脊柱炎等自免疾病中起核心作用。IL-17主要由Th17细胞、γδT细胞和先天性淋巴细胞产生,通过与靶细胞上的IL-17受体结合,诱导下游信号通路的激活,从而促进炎症反应。传统抗IL-17单抗(如司库奇尤单抗、依奇珠单抗)虽疗效显著,但需每月皮下注射。DC-806是礼来公司研发的一种IL-17A亚基的小分子抑制剂。与JNJ-77242113拮抗作用机制不同,该化合物直接结合IL-17A亚基,阻断其与受体相互作用[12](图5)。
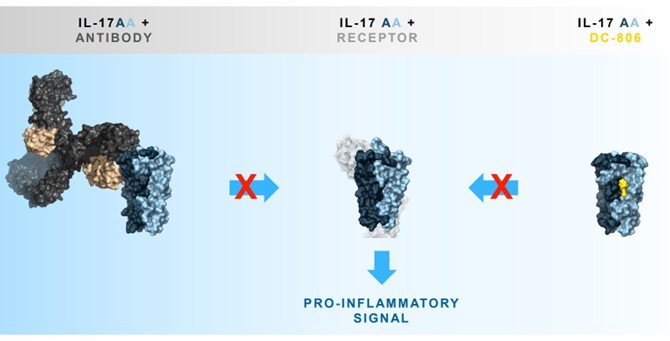
图5. DC-806通过变构结合阻断与抗体相同的靶点作用位点[12]
在一项包含40名参与者的I期概念验证研究中,每日两次服用800mgDC - 806的参与者在4周时平均PASI评分的降低幅度明显大于安慰剂组( -43.7% vs - 13.3%)。而低剂量(175mg每日两次)的DC-806治疗未显示出临床显著益处。不良事件的严重程度为轻度至中度,无剂量依赖性趋势。常见不良事件包括头痛、腹部不适和COVID–19轻度感染。未报告因不良事件导致的停药或实验室异常的临床显著变化。目前,DC-806正在一项IIb期剂量范围试验中进行研究,其主要终点为12周时的PASI 75应答率[7]。
3.2 TAK-279药物及TYK2抑制剂
TYK2是负责多种细胞因子信号(包括IL-12、IL-23和Type I interferons)转导的酪氨酸激酶,与多种自免疾病密切相关。TAK-279(原名NDI-034858)是武田制药开发的一种变构TYK2抑制剂。在临床前试验中,由于其变构结合口袋中的单个氨基酸差异,TAK-279对TYK2-JH2结构域的选择性比氘可来昔替尼高13.0×10⁴倍 (KD=3.8 pM),从而防止其与JAK1结合。作为一款口服小分子,TAK-279经过一系列药代动力学优化,可在肠道吸收并高效进入血流[13],半衰期也被延长至6-8小时(图 6)。
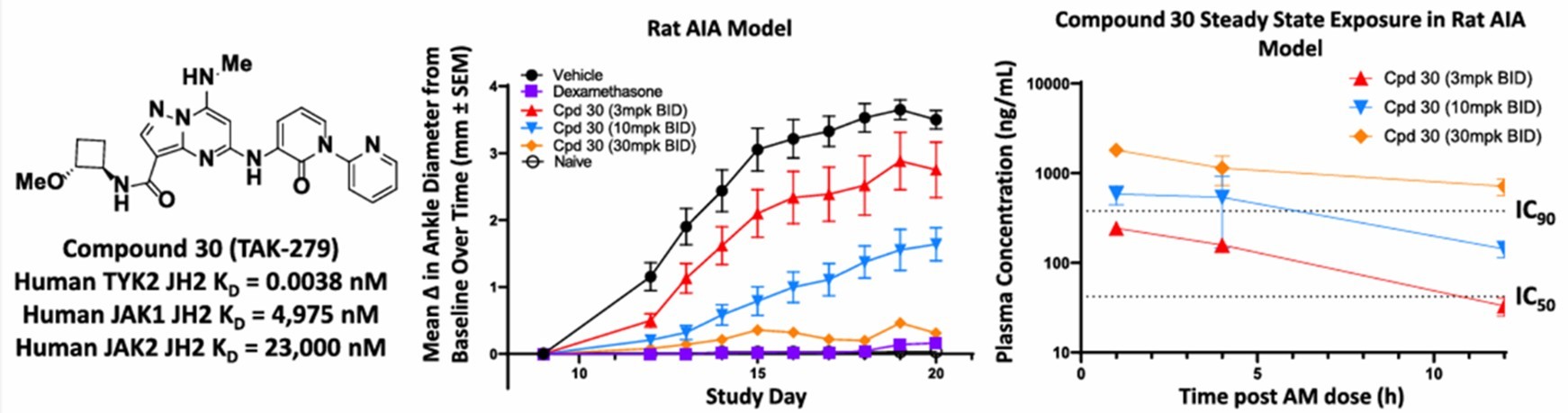
图6. TYK2- JH2构型抑制剂TAK–279在大鼠模型中的口服药代动力学与药效学分析[13]
当前,TAK-279已在多项II期临床试验中验证了其疗效和安全性,其在临床剂量条件下表现出强劲的疗效,显著改善银屑病、关节炎等疾病的临床指标。在一项针对银屑病的II期临床试验(NCT04999839)中,259名参与者被随机分为五组,分别每日一次接受2mg、5mg、15mg、30mg的TAK-279或安慰剂治疗12周。主要终点达成,所有三个治疗组(5mg、15mg和30mg组分别为44%、68%和67%)在12周时达到PASI 75应答的患者比例显著高于安慰剂组。5mg、15mg、30mg和安慰剂组分别有21%、45%、46%和0%的参与者达到PASI 90,30 mg组有33%的患者在12周时报告皮肤完全清除(PASI 100应答)。最常见的不良事件是轻度感染、痤疮、痤疮样皮炎和腹泻。15mg组报告了两起严重不良事件,但被认为与研究药物无关。任何治疗组均未报告实验室数据(包括血液学、肾脏、肝脏和脂质参数)的不良趋势[7]。
3.3 SAR441566及TNF受体阻断剂
肿瘤坏死因子(TNF)是一种重要的促炎细胞因子,在多种自免疾病的发生发展中起着关键作用。TNF主要由巨噬细胞、T细胞和B细胞产生,通过与靶细胞上的TNF受体(TNFR1和TNFR2)结合,诱导下游信号通路的激活,从而促进炎症反应。TNF-α是自免领域最早被验证的经典靶点之一,抗TNF-α抗体(如英夫利西单抗、阿达木单抗)已广泛应用多年,但作为口服药物面临挑战。SAR441566是赛诺菲公司研发的一种用于银屑病早期开发的TNF细胞因子小分子抑制剂。它通过稳定可溶性TNF三聚体的不对称形式,阻止其与TNFR1相互作用,从而抑制促炎细胞因子的产生[14],如图 7所示。

图7. SAR441566通过与可溶人源TNF亲和力结合抑制TNF介导的信号通路[14]
在一项I期双盲、安慰剂对照、随机试验中,该试验招募了38名轻度至中度银屑病患者,每日两次口服SAR441566或安慰剂,持续4周。治疗组中有58%的参与者在4周时研究者整体评估评分降低1分,而安慰剂组为0%(p=0.003)。目标病变严重程度和银屑病面积及严重程度指数(PASI)评分的平均变化有利于治疗组,在4周时观察到统计学上的显著降低。参与者对该药物耐受性良好,未报告严重不良事件。目前,SAR441566正在一项针对银屑病的II期试验中进行研究,主要终点为12周时的PASI 75应答率[7]。
3.4 α4β7整合素及MORF-057药物
α4β7整合素是一种主要表达在特定淋巴细胞亚群表面的粘附分子,它与肠道血管内皮细胞上的粘膜地址素细胞粘附分子-1(MAdCAM-1)结合,介导淋巴细胞向肠道组织的选择性迁移。阻断α4β7整合素的功能,可以减少炎症细胞浸润到肠道,是治疗炎症性肠病(IBD,如溃疡性结肠炎和克罗恩病)的一种精准策略。注射用抗α4β单抗维得利珠单抗(Vedolizumab)已证明了该靶点的有效性。
MORF-057 (MorphoSys) 是一款口服小分子α4β7整合素抑制剂,由礼来和Morphic共同开发。目前,MORF-057正在进行针对中重度溃疡性结肠炎(UC)的II期临床试验。其目的是评估不同剂量MORF-057在诱导UC患者临床缓解和内镜改善方面的疗效和安全性。口服小分子相比抗体,可能更容易实现口服给药,并有望在肠道局部发挥作用,减少全身暴露[15]。2023年4月,Morpic公布了MORF-057(100mg,每日2次)治疗中重度UC的II期EMERALD-1研究(n=35)结果。结果显示,患者接受治疗12周后,Robarts组织病理学指数(RHI)评分显著下降(-6.4分,P=0.002);25.7%患者达到临床缓解,45.7%患者达到临床应答。
PN-943 (Protagonist Therapeutics) 是另一款靶向α4β7整合素的口服多肽药物,也处于临床开发阶段(曾进行II期IDEAL研究,用于UC)[16]。与JNJ-77242113类似,PN-943也需要利用肽工程技术来克服口服递送的挑战。然而,Protagonist在2023年曾宣布未达到主要终点,后续开发策略可能调整。
4、自免类潜在新靶点
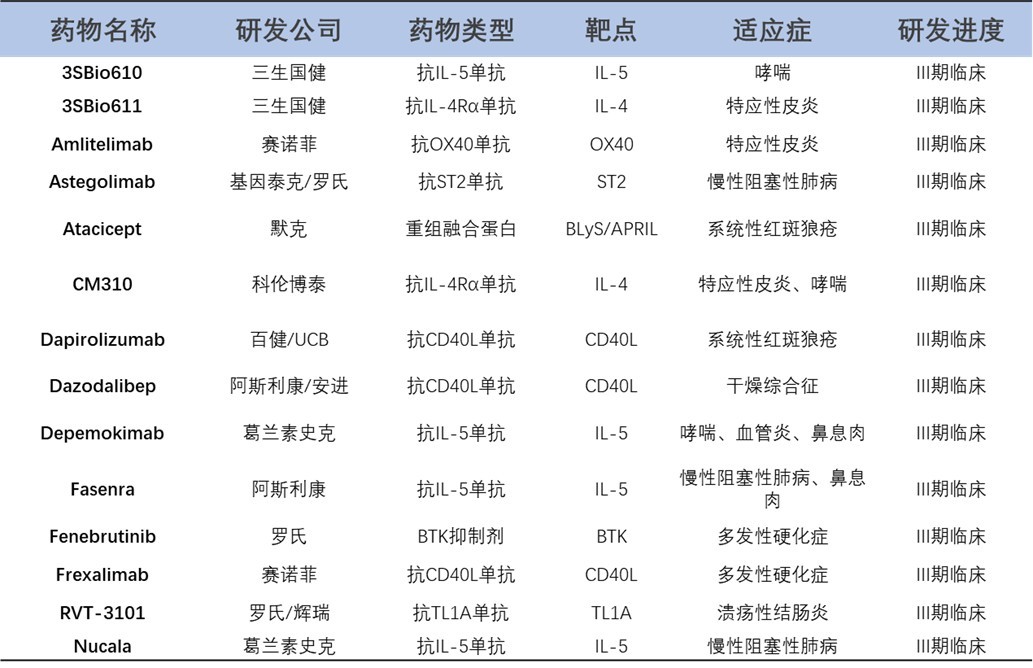
未来几年,自免领域有望继续诞生多款first-in-class疗法。在皮肤病学领域,安进的rocatinlimab(OX40单抗)和赛诺菲的amlitelimab(OX40L单抗)是靶向OX40/OX40L T细胞激活轴的新型药物,有望解决IL-4和IL-13产生的关键上游调节因子。慢性阻塞性肺疾病(COPD)患者也有望受益于一类新型治疗药物:IL-33单抗itepekimab及tozorakimab均处于III期临床。此外,靶向CD40/CD40L轴可能为系统性疾病带来新的治疗方案,包括治疗Sjögren综合征的dazodalibep(CD40L拮抗剂)和治疗系统性红斑狼疮的dapirolizumab(CD40L单抗)。克罗恩病和溃疡性结肠炎可能受益于一类新型TL1A靶向药物,有三个重要候选分子:tulisokibart(TL1A单抗,III期临床,默沙东)、RVT-3101(TL1A单抗,III期临床)、duvakitug(TL1A单抗,II期临床,Sanofi/Teva)。其他新兴靶点:如IL-4、IL-33和IL-18,以及与IL-1家族相关的IRAK4和TSLP等[17](表 3)。
表3. 位于临床实验III期的潜在自身免疫新靶点[17]
5、总结
综上所述,多肽口服药物领域正在蓬勃发展,自免类口服多靶点药物展现出显著治疗潜力。目前,强生、礼来、武田等跨国药企已布局多款临床阶段产品,科伦博泰、三生国健等国内企业在IL-17、IL-5等赛道加速跟进。
多肽药物凭借其独特优势成为口服自免药物开发的重要方向:相较于抗体药物,其分子量更小(1-10 kDa),组织渗透性更佳;相比小分子化合物,则具有更高的靶点选择性和结合亲和力。通过非经典氨基酸引入和分子内交联等工程技术,现代多肽药物已成功克服胃肠道酶解难题,实现了可观的口服生物利用度。典型案例如Protagonist Therapeutics与强生合作开发的IL-23R拮抗剂JNJ-77242113。
从研发策略来看,基于已验证靶点(如IL-23、IL-17,TNF及TYK2)开发更安全有效的药物具有更高的成功概率,而IL-5、IL-4,TL1A、OX40、IL-33等新机制靶点的临床转化仍存在较大不确定性。在技术层面,针对肠道、皮肤等靶组织的局部递药系统(如Sorriso公司的口服纳米抗体技术)将成为差异化竞争的关键,最终其科学性和临床应用价值仍需通过临床试验进一步验证。
参考文献
- 1.Navia, M.; Chaturvedi, P. Design Principles for Orally Bioavailable Drugs. Drug DiscoveryToday1996, 1 (5), 179–189. https://doi.org/10.1016/1359-6446(96)10020-9.
- 2.Price, D. A.; Mathiowetz, A. M.; Liras, S. Designing Orally Bioavailable Peptide and Peptoid Macrocycles. In Practical Medicinal Chemistry with Macrocycles; Marsault, E., Peterson, M. L., Eds.; Wiley, 2017; pp 59–76.https://doi.org/10.1002/9781119092599.ch3.
- 3.Rembratt, A.; Graugaard-Jensen, C.; Senderovitz, T.; Norgaard, J.; Djurhuus, J. Pharmacokinetics and Pharmacodynamics of Desmopressin Administered Orally versus Intravenously at Daytime versus Night-Time in Healthy Men Aged 55?70□years. Eur J Clin Pharmacol2004, 60 (6). https://doi.org/10.1007/s00228-004-0781-9.
- 4.Aroda, V. R.; Blonde, L.; Pratley, R. E. A New Era for Oral Peptides: SNAC and the Development of Oral Semaglutide for the Treatment of Type 2 Diabetes. Rev Endocr Metab Disord2022, 23 (5), 979–994. https://doi.org/10.1007/s11154-022-09735-8.
- 5.Song, Y.; Li, J.; Wu, Y. Evolving Understanding of Autoimmune Mechanisms and New Therapeutic Strategies of Autoimmune Disorders. Sig Transduct Target Ther2024, 9 (1), 263. https://doi.org/10.1038/s41392-024-01952-8.
- 6.Berger, S.; Seeger, F.; Yu, T.-Y.; Aydin, M.; Yang, H.; Rosenblum, D.; Guenin-Macé, L.; Glassman, C.; Arguinchona, L.; Sniezek, C.; Blackstone, A.; Carter, L.; Ravichandran, R.; Ahlrichs, M.; Murphy, M.; Pultz, I. S.; Kang, A.; Bera, A. K.; Stewart, L.; Garcia, K. C.; Naik, S.; Spangler, J. B.; Beigel, F.; Siebeck, M.; Gropp, R.; Baker, D. Preclinical Proof of Principle for Orally Delivered Th17 Antagonist Miniproteins. Cell2024, 187 (16), 4305-4317.e18. https://doi.org/10.1016/j.cell.2024.05.052.
- 7.Drakos, A.; Torres, T.; Vender, R. Emerging Oral Therapies for the Treatment of Psoriasis: A Review of Pipeline Agents. Pharmaceutics2024, 16 (1), 111. https://doi.org/10.3390/pharmaceutics16010111.
- 8.De Leon-Tabaldo, A.; Strawn, D.; Chang, L.; Cheng, X.; Greving, C.; Knight, B.; Sendecki, J.; Sherlock, J.; Modi, N. B.; Kannan, A.; Fourie, A. P626 JNJ-77242113, an Oral Peptide Selectively Targeting the IL-23 Receptor, Demonstrates Pharmacodynamic Activity in Rat and Human Colon Tissue Explants Following Oral Dosing. Journal of Crohn’s and Colitis2024, 18 (Supplement_1), i1202–i1202. https://doi.org/10.1093/ecco-jcc/jjad212.0756.
- 9.Fourie, A. M.; Cheng, X.; Chang, L.; Greving, C.; Li, X.; Knight, B.; Polidori, D.; Patrick, A.; Bains, T.; Steele, R.; Allen, S. J.; Patch, R. J.; Sun, C.; Somani, S.; Bhandari, A.; Liu, D.; Huie, K.; Li, S.; Rodriguez, M. A.; Xue, X.; Kannan, A.; Kosoglou, T.; Sherlock, J. P.; Towne, J.; Holland, M. C.; Modi, N. B. JNJ-77242113, a Highly Potent, Selective Peptide Targeting the IL-23 Receptor, Provides Robust IL-23 Pathway Inhibition upon Oral Dosing in Rats and Humans. Sci Rep 2024, 14 (1), 17515. https://doi.org/10.1038/s41598-024-67371-5.
- 10.Bissonnette, R.; Pinter, A.; Ferris, L. K.; Gerdes, S.; Rich, P.; Vender, R.; Miller, M.; Shen, Y.-K.; Kannan, A.; Li, S.; DeKlotz, C.; Papp, K. An Oral Interleukin-23–Receptor Antagonist Peptide for Plaque Psoriasis. N Engl J Med2024, 390 (6), 510–521. https://doi.org/10.1056/NEJMoa2308713.
- 11.Johnson & Johnson. Icotrokinra Delivered an Industry-Leading Combination of Significant Skin Clearance with Demonstrated Tolerability in a Once Daily Pill in Phase 3 Topline Results; 2024. https://innovativemedicine.jnj.com/our-innovation/focus-areas/immunology/icotrokinra-delivered-an-industry-leading-combination-of-significant-skin-clearance-with-demonstrated-tolerability-in-a-once-daily-pill-in-phase-3-topline-results.
- 12.Warren R.B. DC-806, an Oral IL-17A Inhibitor: Proof-of-Concept in Adults with Mild to Moderate Psoriasis; Proceedings of the AAD Annual Meeting; New Orleans, LA, USA. 17–21 March 2023.
- 13.Leit, S.; Greenwood, J.; Carriero, S.; Mondal, S.; Abel, R.; Ashwell, M.; Blanchette, H.; Boyles, N. A.; Cartwright, M.; Collis, A.; Feng, S.; Ghanakota, P.; Harriman, G. C.; Hosagrahara, V.; Kaila, N.; Kapeller, R.; Rafi, S. B.; Romero, D. L.; Tarantino, P. M.; Timaniya, J.; Toms, A. V.; Wester, R. T.; Westlin, W.; Srivastava, B.; Miao, W.; Tummino, P.; McElwee, J. J.; Edmondson, S. D.; Masse, C. E. Discovery of a Potent and Selective Tyrosine Kinase 2 Inhibitor: TAK-279. J. Med. Chem. 2023,66 (15), 10473–10496. https://doi.org/10.1021/acs.jmedchem.3c00600.
- 14.Vugler, A.; O’Connell, J.; Nguyen, M. A.; Weitz, D.; Leeuw, T.; Hickford, E.; Verbitsky, A.; Ying, X.; Rehberg, M.; Carrington, B.; Merriman, M.; Moss, A.; Nicholas, J.-M.; Stanley, P.; Wright, S.; Bourne, T.; Foricher, Y.; Zhu, Z.; Brookings, D.; Horsley, H.; Heer, J.; Schio, L.; Herrmann, M.; Rao, S.; Kohlmann, M.; Florian, P. An Orally Available Small Molecule That Targets Soluble TNF to Deliver Anti-TNF Biologic-like Efficacy in Rheumatoid Arthritis. Front. Pharmacol. 2022, 13, 1037983. https://doi.org/10.3389/fphar.2022.1037983.
- 15.Ray, A.; Cui, D.; Lee, D.; Mangada, M. M.; Jones, J.; Bain, G.; Traber, P. G.; Vrishabhendra, L. H.; Krzeski, P. W.; Vande Casteele, N.; Reardon, M. M.; Stern, T. P.; Soo, C. L.; Nguyen, H.; Rogers, B. N.; Linde, P. G. P306 MORF-057, an Oral Selective Α4β7 Integrin Inhibitor for Inflammatory Bowel Disease, Leads to Specific Target Engagement in a Single and Multiple Ascending Dose Study in Healthy Subjects. Journal of Crohn’s and Colitis2021, 15 (Supplement_1), S333–S335. https://doi.org/10.1093/ecco-jcc/jjab076.430.
- 16.Cheng, L.; Venkataraman, S.; Zhao, L.; Lee, L.; Tang, T.; Liu, D.; Mattheakis, L. P004 PN-943, an Oral Α4β7 Integrin Antagonist, Inhibits MAdCAM1-Mediated Proliferation and Cytokine Release from CD4+ T Cells Independent of Trafficking. Journal of Crohn’s and Colitis2020, 14 (Supplement_1), S131–S131. https://doi.org/10.1093/ecco-jcc/jjz203.133.
- 17.Fauconnier, A.; Melis, M.; Berenbeck, M.; Pio, B.; Croisier, T. Trends in the Drug Target Landscape for Autoimmune Diseases. Nat Rev Drug Discov2025, d41573-025-00061–00067. https://doi.org/10.1038/d41573-025-00061-7.
*声明:本文仅是介绍医药疾病领域研究进展或简述研究概况或分享医药相关讯息,并非也不会进行治疗或诊断方案推荐,也不对相关投资构成任何建议。



