肿瘤局部内放射治疗的突破性进展:成功开发一种新型温敏、可注射、可降解“粒子”有望替代金属放射粒子
发布时间:
2025-06-06
作者:
刘文革 博士,中晟全肽研发战略部执行总监
引言
在实体瘤的局部放射治疗领域,碘125(I-125)放射性封闭粒子凭借其稳定的辐射性能长期占据主导地位。然而,随着精准医疗的发展,传统碘125粒子植入的局限性日益凸显:不可降解材料导致异物残留、单次植入剂量固定、辐射能量单一及粒子迁移等问题,严重制约了其在复杂临床场景中的应用拓展。在此背景下,以温敏类弹性蛋白为载体的新型内放射核素药物(ELP-BT)研发成功。凭借其可注射、可降解、可携带多种同位素、相变黏连固定放射源等优势,有望成为传统放射性粒子的功能性替代和互补疗法,为实体瘤的局部内放射治疗开辟更广阔的临床应用前景。
1、碘-125粒子的局限性
近年来,在西方国家临床上碘-125放射性封闭粒子被广泛应用于永久低剂量(Low-dose-rate, LDR)近距离放射性治疗。尤其在早期前列腺癌(Prostate cancer, PCa)治疗中,该技术展现出显著疗效:植入后 15 年的长期随访数据表明,患者总体生存率达 81%,PCa特异性生存率高达 95%[1]。此外,碘-125 粒子近距离放疗的应用范围已拓展至头颈部肿瘤、肺癌、乳腺癌、直肠癌等多种实体瘤,均取得了良好的治疗效果[2, 3]。尽管125I放射性封闭粒子在临床广泛应用,尤其在早期PCa治疗中获得高度临床认可,被认为是一种安全有效的、并发症低的治疗手段,但还是存在一些局限性,包括:
(1)依赖精湛的外科操作技术,通过植入手术将一定量(80-120个)粒子植入整个(前列腺)肿瘤。精准布源不仅需严格遵循治疗计划,更依赖术者长期培训积累的操作经验;
(2)对周围组织的辐射损伤可引发显著副作用:在前列腺癌治疗中,粒子放置不当可能导致泌尿生殖系统并发症(如尿失禁、性功能障碍)及粒子移位;此外,固定所有粒子的位置需进行10-20次的针插,这种有创操作易诱发前列腺水肿性炎症反应,导致患者需留置导尿10天以上;
(3)单一核素(如I-125)的能量特性限制了其在乏氧或大体积肿瘤治疗中的应用,并且复杂的手术流程及侵入性操作增加了患者创伤负担和治疗成本;
(4)在治疗过程中粒子的迁移,将导致治疗计划失败和毒性产生。
近年来,智能高分子材料载体的研发取得突破性进展:利用其可注射,可自组装或凝集交联成一个整体的“粒子”,有效避免了传统粒子的移位风险与分布不均缺陷;同时,在影像指导下,其在肿瘤内的分布可控,更有利于放射同位素在肿瘤的均匀分布,为上述临床难题提供了创新性解决方案[4, 5]。
2、ELP-BT介绍
类弹性蛋白多肽(Elastin-like polypeptide,ELP)是一种衍生于天然人体中的弹性蛋白,通过基因重组技术人工合成的温敏性生物可降解多肽聚合物。其核心优势在于具备精准可调的温度响应和可逆相转变特性——当环境温度低于相变温度(Tt)时呈液态,超过 Tt 则迅速凝集。ELP的相变温度可精准设定为低于体温(~20℃),在室温(23℃)环境下呈液态便于注射,而当注入肿瘤组织后,温度升高(≥33℃),使ELP发生相变凝集。这种温敏性响应机制使得与ELP偶联的放射核素,能够通过温度触发的物理锚定效应,被高效滞留于注射部位,实现放射核素在肿瘤内的局部持续衰变释放辐射能,发挥从里至外的肿瘤杀伤作用,应用合适的治疗计划后,精准设定安全区边界,还可减少对周围正常组织的辐射损伤。此外,ELP除了可荷载放射碘外,还能高效负载其他α或β放射性核素(如At-211, R-225、Y-90、Lu-177等)(图1)。
基于以上特性,我们开发了一款新型ELP-BT,并完成了临床前研究。经过建库,筛选和性能评价,优化后的ELP的Tt< 25°C,在瘤内注射后可迅速发生相变凝集,实现核素在肿瘤内的稳定滞留(滞留时间>60天)。在头颈部鳞癌模型中,以2 mCi/150 mm³剂量进行局部注射后,肿瘤完全缓解率达100%,且全身毒性可控,体内分布符合预期(图1)。目前,该药物已完成系统的成药性评价,具备专利转化条件,在治疗计划系统开发后,可实施临床转化。本研究为实体瘤提供了可注射、可降解、灵活化、多模态协同的放射治疗新策略,有望突破传统局部内放射治疗技术的局限性。其优异的临床前研究结果表明,该技术具备明确的临床转化路径。
当前尚需开发适配于ELP-BT的精准治疗计划系统(如放射粒子的治疗计划),借此精准计划ELP-BT的注射量和位置,预测肿瘤的治疗体积和安全边界,从而达到消除肿瘤却不影响健康周围组织的目的。未来转化成功后,ELP-BT有望成为金属放射粒子的重要补充和替代药品,为晚期实体瘤的治疗增添一种安全、高效的新型疗法。
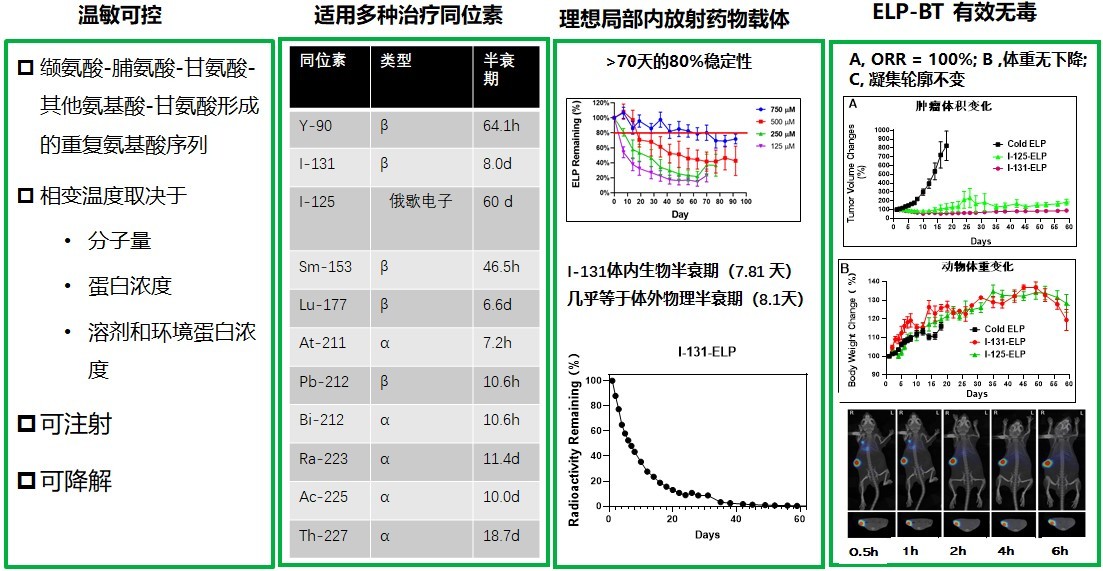
图1. ELP特性和ELP-BT的抗肿瘤作用
3、比较放射性封闭粒子和可注射ELP-BT
3.1 材料革命:从"异物残留"到"体内降解"
传统碘125粒子:采用钛合金外壳封装,术后永久存留体内,造成身体和心理上的不适,还可能引发慢性炎症或组织纤维化。ELP-BT突破点:在完成放射治疗使命后,载体材料逐步降解成氨基酸,为人体营养所用,避免异物反应,显著降低长期并发症风险。
3.2 治疗方式革新:从复杂的"手术植入"到简单的"微创注射"
碘125粒子:尽管125I粒子治疗对肿瘤具有明确的杀伤作用,且对周围正常组织损伤小,但仍存在显著的局限性:需通过植入针反复穿刺实现粒子植入,穿刺过程中可能因深度控制偏差或多次刺入,将不可避免地导致局部放射性炎症反应、水肿、坏死、形成溃疡和消化道出血等严重并发症;同时,粒子置放的准确性高度依赖术者的经验和精湛技术,所以需要经验积累和培训才能掌握植入技术。若能通过生物载体携带放射核素,通过瘤内简单注射完成放射核素植入,凭借操作流程简便可控、可精准控制药物分布深度的特性,规避传统手术的复杂性及粒子针反复穿刺风险,无疑为实体瘤的治疗提供了一种更为安全、便捷的治疗方向。ELP-BT突破点:通过预装式注射器将ELP-BT直接注射至肿瘤靶区,利用肿瘤的温度(>33°C)与ELP相变温度(20°C)的天然梯度差,触发ELP的温敏相变,瘤内注射后立即在肿瘤组织间隙凝集固定,形成高密度辐射场。这一技术不仅简化操作流程、降低医患辐射暴露风险,更适用于深部肿瘤或复杂解剖部位肿瘤的精准治疗。
3.3 动态调控:从"单次剂量固化"到"灵活多次给药"
碘125粒子:半衰期长(60.1天),单次植入后剂量无法调整,可能造成早期剂量不足或晚期辐射过量。ELP-BT突破点:ELP的核素标记可在术前实时完成,支持根据肿瘤退缩情况动态分次注射,从而实现放射剂量分布的动态优化;并且具备多种核素标记能力,对治疗相对不敏感的肿瘤,可及时更换核素类型(比如用高杀伤能力的α核素替换低杀伤的β核素);同时,结合影像引导技术,可实现"剂量绘画"(Dose Painting),尤其适用于边界不清或浸润性生长的肿瘤精准治疗。
3.4 能量协同:从"单一同位素"到"多核素联用"
碘125粒子:仅释放低能γ射线(35.5 keV),穿透力弱,对体积较大或异质性肿瘤覆盖率有限。ELP-BT突破点:载体可负载β核素,如碘-131(I-131),钇-90(Y-90)、镥-177(Lu-177)或α核素,锕-225(Ac-225)、镧-211(La-211)等多种同位素,通过混合载药或序贯注射,实现不同射线能量(β/α)与半衰期的组合。例如:Y-90(β射线):深部穿透,针对体积较大肿瘤;Lu-177(β/γ射线):兼具局部杀伤与全身显像功能;定制化方案:根据肿瘤类型、大小及周围敏感器官,设计个性化核素"鸡尾酒"。
3.5 粘连周围组织避免“粒子迁移”
碘125粒子:碘125粒子前列腺近距离治疗的临床研究显示,术后粒子迁移率为28.8%(320例中92例)[6]。ELP-BT突破点:既往研究发现,ELP瘤内注射后发生相变凝集,其弹性蛋白基质与周围组织形成生物黏附,使注射区域形态在数天内保持稳定。这种物理黏附特性可将放射粒子锚定于注射区域,避免了金属粒子的迁移。
4、总结
综上所述,ELP凭借温敏相变凝集、可降解、可注射、可重复给药和可适配多种放射性核素的特性,结合专属治疗计划系统和给药注射装置,重塑局部内放射肿瘤治疗模式,实现晚期实体瘤的精准控制。温敏ELP-BT通过精准控释、灵活治疗等优势,可有效补充或替代不可降解的密封籽源的临床局限性,预示其在晚期实体瘤治疗领域将具备显著的竞争力。未来研究需进一步优化ELP的分子设计、提升核素负载效率并探索临床联合治疗方案,以加速其从实验室向临床床旁的转化应用(图2)。
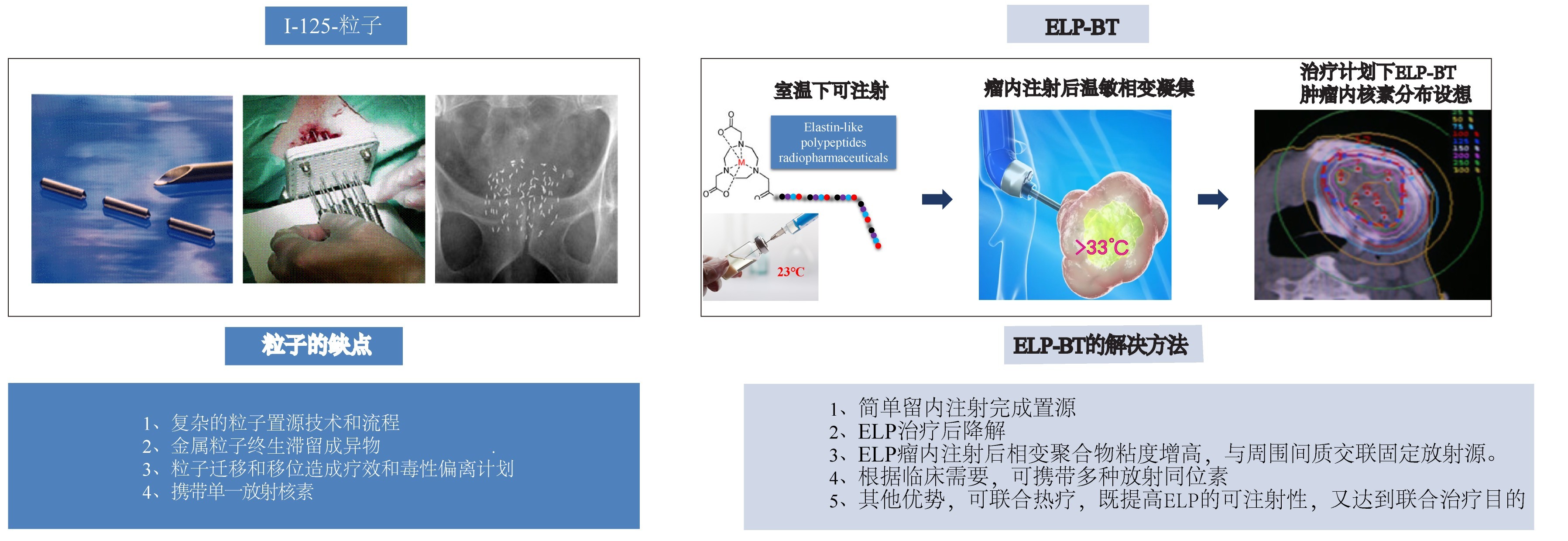
图2. I-125密封籽源存在问题和ELP-BT的解决方法
参考文献
- 1.Uribe-Lewis, S., et al., Long-term survival after low-dose-rate brachytherapy for prostate cancer: the Royal Surrey experience. BJU Int, 2022. 129(6): p. 723-730.
- 2.Wei, S., et al., Radioactive Iodine-125 in Tumor Therapy: Advances and Future Directions. Front Oncol, 2021. 11: p. 717180.
- 3.赵明星等, 近距离放射治疗在消化系肿瘤治疗中的应用前景. 国际消化病杂志, 2013. 33(03): 第160-164+179页.
- 4.Seniwal, B., et al., Recent Advances in Brachytherapy Using Radioactive Nanoparticles: An Alternative to Seed-Based Brachytherapy. Front Oncol, 2021. 11: p. 766407.
- 5.Liu, W., et al., Brachytherapy using injectable seeds that are self-assembled from genetically encoded polypeptides in situ. Cancer Res, 2012. 72(22): p. 5956-65.
- 6.Miyazawa, K., et al., Seed migration after transperineal interstitial prostate brachytherapy with I-125 free seeds: analysis of its incidence and risk factors. Jpn J Radiol, 2012. 30(8): p. 635-41.
*声明:本文仅是介绍医药疾病领域研究进展或简述研究概况或分享医药相关讯息,并非也不会进行治疗或诊断方案推荐,也不对相关投资构成任何建议。



