多肽偶联药物(PDC)该如何破局?
发布时间:
2025-07-16
作者:
李福燕,中晟全肽研发战略部研究员
引言
药物偶联物已成为一种极具前景的新型给药系统,旨在将足够的有效载荷精准递送至肿瘤部位,从而在最大程度地提高治疗效果的同时降低毒性。抗体药物偶联物(Antibody-drug conjugates, ADCs)因其在癌症治疗中的巨大潜力,受到了学术界和工业界的广泛关注,1957年Mathé首次将甲氨蝶呤与抗白血病1210抗原免疫球蛋白偶联用于治疗白血病,由此拉开了药物偶联物的研究序幕,2000年首个ADC药物Mylotarg获得FDA加速批准上市,至今已有19个ADC药物上市。多肽偶联药物(Peptide-drug conjugates, PDC)是继ADC之后的下一代靶向抗肿瘤药物,由肽、连接子和有效载荷(可以为抗肿瘤药物、放射性核素等多种形式)组成,但是从20世纪90年代至21世纪初科学家们对多肽偶联药物进行初步研究至今只有3个上市药物。2018年,FDA批准诺华的Lutathera上市,用于治疗胃肠胰腺神经内分泌肿瘤,这是全球第一款PDC上市药物,也是一种肽受体放射性核素治疗药物。2021年2月,FDA批准了Oncopeptides公司的Pepaxto上市,是全球第一款上市的靶向氨肽酶类的 PDC 药物,用于治疗复发性或难治性多发性骨髓瘤成人患者,但因后续研究显示其会导致死亡风险增加,已被FDA撤回。2022年,诺华的另一款RDC药物Pluvicto获批用于治疗前列腺癌患者,是治疗用核药的又一个里程碑事件。本文将从靶点特性、亲和力与内吞特点、PK数据(稳定性和半衰期)及有效载荷等方面对现有成功上市的Lutathera和Pluvicto进行详细分析,探索出PDC的破局之法,为PDC的开发提供新思路。
1、靶点特性
靶点的选择对于靶向治疗药物的开发是重中之重,在选择靶点之前需要对靶点本身的特性进行详细分析。
1.1 Lutathera 特性
Lutathera靶向的是生长抑素受体2(Somatostatin Receptor 2,SSTR2),用于治疗胃肠胰腺神经内分泌肿瘤。SSTR2是生长抑素受体家族(SSTR1-5)成员之一,有SSTR2A与SSTR2B两种变构体,属于G蛋白偶联受体,是一种七次跨膜蛋白,当SST和SSTR结合后,SSTR胞内偶联的G蛋白会发生构象变化,从而激活下游的信号通路,这种配体与受体的结合是自然界存在的特异性结合方式之一,PDC药物的开发较多是利用这种特异性结合方式。在自然界中,除配体与受体的特异性结合外,还存在多种基于分子结构互补、功能专一性的特异性结合方式,包括ADC药物的抗原与抗体特异性结合、小核酸药物的碱基互补配对结合及小分子药物的酶与底物催化性特异性结合等。在药物开发时,以上天然存在的特异性结合方式展现出多重优势:基于分子结构的精准互补性,药物可如 “锁钥” 般靶向致病靶点,避免对正常生理过程的干扰;同时通过识别病理状态下高表达的受体,实现治疗窗口的选择性,降低毒副作用。因此,在药物开发时可以考虑选择存在这些特异性结合形式的靶点。在正常组织中,SSTR2 mRNA和蛋白广泛表达,在大脑中广泛表达,在胰腺的α细胞和β细胞、肾脏,空肠、结肠和肝脏中也均有表达[1]。但是,有研究发现在小肠神经内分泌肿瘤中SSTR2 mRNA 表达水平是正常小肠组织的8.2 倍(p=0.0042)[2],在胰腺神经内分泌肿瘤中,肿瘤SUVmax中位数为 28.7(范围10–151),而正常胰腺仅为2.1,倍数差异达13.7倍[3]。因此,最好保证所选靶点在肿瘤组织中表达显著高于正常组织。
1.2 Pluvicto 特性
Pluvicto靶向的是前列腺特异性膜抗原(Prostate-specific membrane antigen,PSMA),用于治疗PSMA阳性的转移性去势抵抗性前列腺癌(mCRPC)。PSMA也称为谷氨酸羧基肽酶II和叶酸水解酶1,是一种II型跨膜糖蛋白,具有叶酸水解酶和N-乙酰-α连接的酸性二肽酶活性,其 95% 的胞外域包含酶活性位点与配体结合区域,易于设计靶向分子。Pluvicto是利用PSMA靶点的酶与底物的高效结合方式,强效杀伤肿瘤细胞。PSMA在正常前列腺组织和非前列腺癌组织(如泪腺、神经系统、十二指肠)中表达水平很低,但在前列腺癌组织中的表达比正常组织高100-1000倍(IHC检测),尤其是在分化差、转移性和去势抵抗性前列腺癌组织中表达水平更高[4]。因此,PSMA对前列腺癌具有良好的组织特异性,在选择靶点时需要肿瘤组织表达显著高于正常组织,与疾病的进展及预后密切相关。同时,有研究发现PSMA 在前列腺癌 LNCaP 细胞表面的密度为1.8×105位点/每细胞,在LN3亚系细胞上的密度为1.3×105位点/每细胞,这证明在前列腺癌细胞膜上有充足的PSMA结合位点[5]。所以,最好选择靶点受体密度高的癌症细胞进行实验,以获得更好的疗效。
综上,在药物开发时可以考虑选择自然界存在特异性结合形式的靶点,靶点在肿瘤组织中的表达显著高于正常组织(SSTR2和PSMA共同的特点),并且与疾病的发生、进展和预后密切相关,实验所使用的癌症细胞需要有充足的靶点结合位点(PSMA靶点的特点)。
2、亲和力和内吞特点
药物开发时,药物靶点的高结合亲和力可增强药物与靶点的特异性结合,而靶点的内吞特性则影响药物进入细胞发挥作用的效率,二者共同决定药物的疗效与安全性。以下将对Lutathera、Pluvicto和上市的靶向Trop2的3个ADC药物:Trodelvy、佳泰莱(SKB-264)、Datroway(Dato-DXd)的结合亲和力与内吞数据进行对比分析。
通过汇总披露的药物数据发现(见图1)[6,7],上市的两个PDC药物与靶点的结合亲和力在纳摩尔级,而上市的靶向Trop2的3个ADC药物能够达到皮摩尔级,显著高于PDC药物,这或许是上市的ADC药物比PDC多的原因之一。PDC亲和力差于ADC可能是因为多肽通常为单价结合模式,而抗体则是通过多价效应进行结合。因此,提高药物与靶点的结合亲和力是药物开发需要着重注意的参数之一。在内吞参数方面,Trodelvy在2h内吞超50%,佳泰莱在2h约达80% ,Datroway在3h超50%,ADC药物在较短时间内可实现较高内吞,利于药物进入细胞发挥作用;然而,在4h时Lutathera和Pluvicto的内吞效率分别只有30.7%、15%,内吞效率和速度整体差于ADC。这可能是因为Lutathera和Pluvicto有效载荷为放射性核素,放射性核素的原子核不稳定,经衰变能自发地放出 α 射线、β 射线等辐射,可以不进入细胞,利用衰变时产生的射线杀死目标细胞。而ADC的有效载荷为负责杀死癌细胞的药物,需要依赖于细胞内吞作用进入肿瘤细胞内,通过溶酶体降解后,以生物活性形式释放并发挥作用,导致癌细胞死亡。所以内吞作用对于有效载荷为放射性核素的PDC不是必须的,而对于有效载荷为杀伤癌细胞的药物时必须要有较好的内吞效率才能发挥较好的疗效。以上数据证明,在药物开发时,需要注意提高药物与靶点的结合亲和力,同时还要根据有效载荷的类型提升药物的内吞效率。
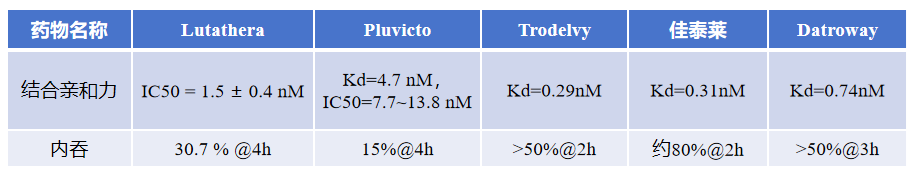
图1. PDC与ADC药物结合亲和力和内吞数据汇总
3、PK数据(稳定性和半衰期)
药物稳定性和半衰期是药物动力学中两个重要参数,药物的稳定性是保证药物制剂安全、有效的前提,药物的半衰期是决定药物暴露量、有效性和安全性的关键,更是剂量设置的根本。
通过汇总现有的药物数据发现[8,9],在稳定性方面,Lutathera和Pluvicto在血浆中稳定性都很高,24小时依旧有95%以上的剩余。因为这两个上市PDC药物的payload是放射性核素,若放射性核素脱落,一方面无法精准对肿瘤照射,还可能对正常组织造成不必要辐射损伤;另一方面也会让药物无法按设计发挥作用,影响治疗效果。所以,在开发PDC药物时要注意保持药物的稳定性,以此提高药物的安全性和有效性。在半衰期方面,Lutathera在大鼠中半衰期约22-24分钟,在狗体内的半衰期约60分钟;Pluvicto在大鼠中半衰期约20分钟,在猪体内的半衰期约60分钟。与大多数多肽类药物类似,这两个上市的PDC药物的生物半衰期较短,容易被蛋白酶降解和被肾脏清除,但是通过一些化学修饰,与天然多肽相比半衰期已经有较高提升。因此,提升药物半衰期也是药物开发过程中需要着重注意的一点。
综上所述,提高药物的稳定性和半衰期对于药物的开发至关重要。
4、有效载荷
PDC药物的有效载荷可以是不同的药物形式,包括:抗肿瘤药物,比如紫杉醇、MMAE、SN-38等;放射性核素,用于疾病的精确诊断和肿瘤的靶向放疗,比如镓-68(68Ga)、氟-18(18F)、镥-177(177Lu)、锕-225(225Ac)等;还有蛋白、抗体、多肽和核酸等。Lutathera和Pluvicto均以177Lu为有效载荷,通过精准递送实现 “靶向放疗”,为晚期肿瘤患者提供了高效且低毒的治疗选择。177Lu的半衰期约 6.647 天,使得其在体内停留时间适中,既能够保证在治疗过程中有足够的放射性物质发挥作用,又不会在体内长时间积累,减少了长期辐射的风险,同时还可以满足药物生产、运输的时间从而提高疗法的可及性。177Lu在衰变过程中释放3种不同能量的β射线,能量分别为498 keV(79.3%)、380 keV(9.1%)和176 keV(12.2%),平均能量130keV,组织最大射程约为2.5mm,在治疗的同时可行SPECT显像,实现诊疗一体化的目的[10]。因此,选择优秀的有效载荷有助于提高药物的治疗疗效。
5、总结与展望
从 Lutathera 与 Pluvicto 的上市实践来看,PDC药物的破局需注意以下四大核心要素:一是精准筛选靶点,选择自然界存在配体-受体等特异性结合模式的靶点,确保其在肿瘤组织中高表达、与疾病进展密切相关且癌细胞表面受体密度充足;二是平衡亲和力与内吞效率,尽管PDC与靶点的结合亲和力弱于ADC,但可借助放射性核素载荷的 β 射线无需进入细胞即可杀伤的特性弥补内吞效率不足,而针对需胞内释放的抗肿瘤药物等载荷则需优化内吞效率;三是优化药代动力学,通过稳定的连接子设计防止有效载荷的脱落,并结合肽链环化、PEG 化等化学修饰延长半衰期,以平衡药物在体内的暴露与清除速率;四是战略性选择有效载荷,以177Lu为代表的放射性核素兼具 β 射线杀伤治疗与 γ 射线显像诊断功能,其6.647天的半衰期适配临床运输与给药窗口,为 PDC 提供“诊疗一体化”的独特优势。
未来,通过研究筛选发现更多与肿瘤密切相关的高表达的靶点,利用多价肽结构、噬菌体展示技术提升亲和力,使用化学修饰与改构提高内吞效率、稳定性和半衰期,开发与使用具有更高能量的α核素等多方面的改进,有望突破目前PDC药物发展的瓶颈,推动PDC在更多癌种中实现“精准杀伤、低毒高效”的治疗目标,真正开启靶向治疗的“多肽时代“。
参考文献
- 1.Wang A, Yuan Y, Chu H, Gao Y, Jin Z, Jia Q, Zhu B. Somatostatin Receptor 2: A Potential Predictive Biomarker for Immune Checkpoint Inhibitor Treatment. Pathol Oncol Res. 2022 Feb 21;28:1610196. doi: 10.3389/pore.2022.1610196.
- 2.Klomp MJ, Refardt J, van Koetsveld PM, Campana C, Dalm SU, Dogan F, van Velthuysen MF, Feelders RA, de Herder WW, Hofland J, Hofland LJ. Epigenetic regulation of SST2 expression in small intestinal neuroendocrine tumors. Front Endocrinol (Lausanne). 2023 May 8;14:1184436. doi: 10.3389/fendo.2023.1184436.
- 3. https://jnm.snmjournals.org/content/55/supplement_1/1923.
- 4.He Y, Xu W, Xiao YT, Huang H, Gu D, Ren S. Targeting signaling pathways in prostate cancer: mechanisms and clinical trials. Signal Transduct Target Ther. 2022 Jun 24;7(1):198. doi: 10.1038/s41392-022-01042-7.
- 5.周丽丽,汪兴生.前列腺特异性膜抗原(PSMA)的概况[J].安徽化工,2010,36(01):28-31+34.
- 6.Cheng Y, Yuan X, Tian Q, Huang X, Chen Y, Pu Y, Long H, Xu M, Ji Y, Xie J, Tan Y, Zhao X, Song H. Preclinical profiles of SKB264, a novel anti-TROP2 antibody conjugated to topoisomerase inhibitor, demonstrated promising antitumor efficacy compared to IMMU-132. Front Oncol. 2022 Dec 23;12:951589. doi: 10.3389/fonc.2022.951589.
- 7.Okajima D, Yasuda S, Maejima T, Karibe T, Sakurai K, Aida T, Toki T, Yamaguchi J, Kitamura M, Kamei R, Fujitani T, Honda T, Shibutani T, Muramatsu S, Nakada T, Goto R, Takahashi S, Yamaguchi M, Hamada H, Noguchi Y, Murakami M, Abe Y, Agatsuma T. Datopotamab Deruxtecan, a Novel TROP2-directed Antibody-drug Conjugate, Demonstrates Potent Antitumor Activity by Efficient Drug Delivery to Tumor Cells. Mol Cancer Ther. 2021 Dec;20(12):2329-2340. doi: 10.1158/1535-7163.
- 8.https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-lutetium-lu-177-dotatate-treatment-gep-nets.
- 9.https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-pluvicto-metastatic-castration-resistant-prostate-cancer.
- 10.https://chinanm.cma.org.cn/attach/0/9dd69521bf4c4abf9a1e03263d6ba6d0.pdf.
*声明:本文仅是介绍医药疾病领域研究进展或简述研究概况或分享医药相关讯息,并非也不会进行治疗或诊断方案推荐,也不对相关投资构成任何建议。



