靶蛋白非肿瘤特异性因素对靶向药疗效的影响
发布时间:
2025-03-11
作者:
刘文革 博士,中晟全肽研发战略部执行总监
引言
细胞膜作为细胞与外界环境交流的重要通道,其上的膜蛋白在细胞的生理功能中发挥着至关重要的作用。正常细胞和肿瘤细胞的细胞膜蛋白存在显著差异。肿瘤细胞为实现不受控制的生长、侵袭和转移,会在其表面表达一些特殊的膜蛋白。这些蛋白有的参与细胞生长信号的传递,比如表皮生长因子受体(Epidermal growth factor receptor, EGFR);有的帮助肿瘤细胞逃避免疫系统的监视,像程序性死亡配体 - 1(Programmed cell death ligand 1,PD-L1);还有的在肿瘤血管生成过程中起关键作用,例如血管内皮生长因子受体(Vascular endothelial growth factor,VEGFR)。这些独特的细胞膜蛋白,成为了抗肿瘤药物精准打击的理想靶点。
细胞膜的脂质双层结构如同一个天然屏障,分隔了细胞外和细胞内的物质,使其无法自由交换和直接沟通。因此,环境中的分子或细胞内分子不得不遵循细胞固有法则,借助特异受体、离子通道、转运体、黏附蛋白等完成各自的功能。与传统的细胞毒性化疗不同,靶向细胞表面蛋白的疗法提供了一种提高癌细胞特异性,同时最大限度地减少毒性的策略。许多治疗性靶向药物(如抗癌药)的主要治病机制是通过特异性高表达的靶抗原或膜上受体将非靶向药物递送到肿瘤细胞内,从而达到特异性肿瘤杀伤的效果。
目前,已经开发了多种类型的细胞表面蛋白靶向疗法,具有不同的作用机制。科研人员已对75 种候选的细胞表面蛋白进行了深入研究,但在美国或欧盟,仅有25个治疗相关的细胞表面蛋白被批准用于癌症疗法[1]。尽管抗体-药物偶联物(Antibody-drug conjugate,ADC)和放射性药物疗法(Radiopharmaceutical therapy,RPT)等几类细胞表面靶向疗法已经获得了美国食品药品监督管理局(FDA)的批准,得以应用于临床实践,但不得不承认的是,这些疗法的许多疗效机制至今尚未完全明晰,仍存在着诸多待解之谜。临床抗肿瘤疗效的评估是一个复杂的系统工程,靶点蛋白的肿瘤特异性毋庸置疑是公认的重要指标,但并非唯一的决定因素,还需要考虑其他多种因素,如表达水平(临床常用免疫组织化学(Immunohistochemistry,IHC)和荧光原位杂交(Fluorescence in situ hybridization,FISH)的阳性分数以及生物学特征的丰度)、靶点蛋白的分布特性和肿瘤组织中靶点异质性等。这些因素同样对疗效、毒性以及成药性起着决定性作用。本文将围绕以上几点,对这些因素与靶向药的临床疗效关系逐一进行阐述。
一、膜蛋白表达水平对药物疗效的影响
膜蛋白表达水平通常采用临床常用的IHC和FISH的阳性分数,以及生物学特征的丰度这两种方法进行研究。1)靶点高表达:是指在细胞或组织中,某个特定的靶点(如基因、蛋白质等)的表达水平呈现显著高于正常状态的现象,这可能是由于基因突变、染色体异常、转录调控机制的改变或其他因素所导致。值得注意的是,过表达是一个相对的概念,通过与正常生理状态下的表达情况进行对比后得出,强调的是表达水平的异常增高,这一现象往往与疾病的发生、发展密切相关,例如在许多肿瘤细胞中,某些癌基因会出现过表达,进而促进肿瘤的生长和增殖。2)表达丰度:是指在特定细胞、组织或生物样本中,某种基因或蛋白质的实际含量或数量。它是一个更侧重于量化的概念,主要用来描述靶点在样本中的具体表达量,并不涉及与正常状态的比较,仅仅单纯地反映该靶点在某个环境中的丰富程度。表达丰度可以借助多种技术手段进行测量。在基因层面,可采用PCR、RNA 测序实时定量;在蛋白质层面,可运用蛋白质免疫印迹法(Western blot)、酶联免疫吸附测定(Enzyme-linked immunosorbent assay,ELISA)等方法,得到具体的拷贝数、浓度、相对含量等数值。这二者的区别在于:高表达反映肿瘤组织中阳性细胞的占比情况,属于相对参数,多用于临床研究中的病人筛选。而表达量体现单个细胞内的蛋白个数,如HER-2受体最高表达量可达106,当小于103则被认为是低表达,这是一个定量参数,多用于药物机制研究。
1. 表达水平对临床疗效的影响
在临床实践中,医生通常会通过 IHC 和 FISH 等方法来检测肿瘤细胞的 HER-2 阳性水平,以指导治疗方案的选择并预测患者的预后。一般而言, IHC 检测为 3 + 或 FISH 检测显示基因扩增的患者,被认为是 HER-2 高表达,这类患者更有可能从 HER-2 靶向治疗中获益[2](如下表)。
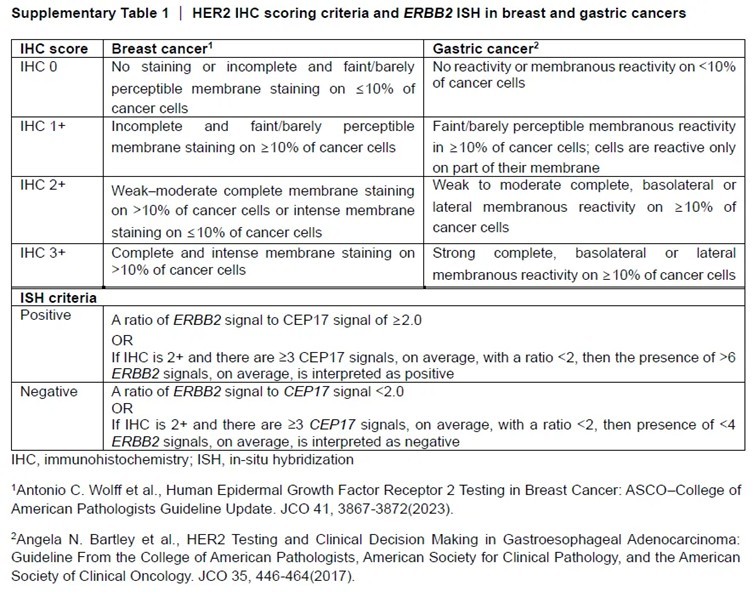
1.1 靶点表达高低对疗效的影响
当靶点处于高表达状态时,可为药物提供更多的结合蛋白,使药物能更充分地发挥作用,进而更有效地抑制肿瘤生长。HER-2 在正常组织中低表达或不表达,但在多种恶性肿瘤中异常高表达。以曲妥珠单抗(HER-2抗体)为例,其对HER-2 3+乳腺癌患者的客观缓解率(ORR)可达50%,而HER-2 1+患者ORR 15%。Destiny-PanTumor02 II期试验(NCT04482309)评估了DS-8201在40例HER-2阳性卵巢癌患者中的疗效和安全性。这些患者中,62.5% 的人属于 HER-2 1+,剩下的则为 HER-2 3+。整体 HER-2 阳性(不区分表达水平高低)的患者组ORR为 45%。进一步细分来看,HER-2 3+患者的ORR达到了63.6%,而 HER-2 2+患者的ORR为 36.8%。此外,与 HER-2 2+患者中位无进展生存期(PFS)的4.1个月相比,HER-2 3+患者的中位PFS更长为12.5 个月,这一数据有力凸显了HER-2表达水平对治疗结果的影响。高表达靶点为抗体药物提供足够结合位点,激活ADCC/CDC效应或阻断信号传导。低表达靶点(IHC ≤ 1+),如EGFR野生型肿瘤,西妥昔单抗对EGFR低表达结直肠癌疗效有限(ORR<10%)。最新靶向TROP2的ADC药物芦康沙妥珠单抗(sacituzumab tirumotecan)治疗三阴乳腺癌临床结果表明,TROP2高表达病人的ORR明显高于TROP2低表达组(见图1)。
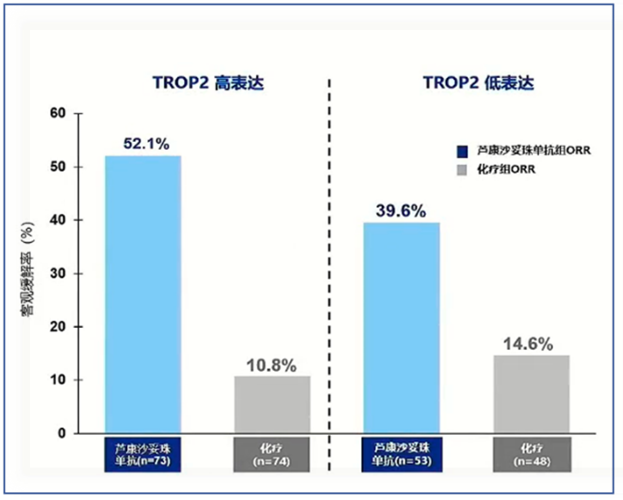 图1 靶向TROP2的ADC药物芦康沙妥珠单抗治疗三阴乳腺癌临床结果
图1 靶向TROP2的ADC药物芦康沙妥珠单抗治疗三阴乳腺癌临床结果
2. 肿瘤细胞表面蛋白表达丰度对靶向药物的临床疗效的影响
细胞表面靶点表达丰度是指细胞表面特定靶点(如蛋白质、受体等)在细胞表面呈现的数量多少或密集程度,它在癌症研究和药物开发等领域意义重大。值得注意的是,靶点表达高低是相对的,同一个靶点,在不同细胞表面的表达量低可至103,高可达106的水平。同样,在同一个细胞表面,不同靶点抗原的表达量也千差万别。细胞表面靶点表达丰度与靶向药物的临床疗效之间存在着复杂又密切的关系,一般体现在以下几个方面:
2.1 丰度与抗肿瘤效果的正相关关系
1)为药物结合提供更多结合位点:细胞表面靶点表达丰度高,意味着有更多的靶点可供靶向药物结合。以曲妥珠单抗治疗 HER-2 阳性乳腺癌为例,HER-2 在肿瘤细胞表面高表达,曲妥珠单抗能与这些过量表达的 HER-2 靶点充分结合,从而更有效地阻断 HER-2 信号通路,抑制肿瘤细胞的增殖和存活,临床疗效往往较好。
2)增强药物效应:靶点的表达丰度高可以增强药物对细胞的作用效果。在非小细胞肺癌中,EGFR 基因突变使得 EGFR 蛋白在肿瘤细胞表面高表达,此时针对 EGFR 的靶向药物如吉非替尼等,便能够与大量的 EGFR 蛋白结合,更强烈地抑制肿瘤细胞的生长、侵袭和转移,提高患者的无进展生存期和总生存期。
2.2 丰度与抗肿瘤效果的负相关关系
1)靶点饱和与竞争:当靶点表达丰度过高时,可能会出现药物无法完全饱和所有靶点的情况,导致部分靶点仍能发挥生物学作用,肿瘤细胞借此逃避药物的抑制。此外,高表达的靶点可能会竞争结合靶向药物,降低药物与靶点的有效结合率,进而影响临床疗效。例如高 EGFR 拷贝数的EGFR 突变型肺癌患者的奥希替尼(第三代EGFR-TKI药物)结合率较基线下降 30-50%,出现疗效平台期。
2)诱导耐药机制:细胞表面靶点过度表达可能会激活其他旁路信号通路或耐药机制。例如在某些肿瘤中,HER-2 过度表达可能会通过激活 PI3K/AKT 等旁路信号通路,使肿瘤细胞对 HER-2 靶向药物产生耐药性,导致临床疗效降低。
2.3 复杂的非线性关系
1)最佳表达范围:对于一些靶向药物,细胞表面靶点存在一个最佳的表达丰度范围,在此范围内药物疗效最佳。靶点表达过低,药物作用靶点不足,疗效不佳;靶点表达过高,又可能引发上述的饱和、竞争或耐药等问题。如在黑色素瘤中,BRAF V600E 突变靶点的表达丰度与维莫非尼等 BRAF 抑制剂的疗效就呈现出这种非线性关系,只有当 BRAF V600E 突变靶点在一定表达水平时,药物才能发挥出最佳的临床疗效。
2)个体差异和肿瘤异质性:不同患者之间肿瘤细胞表面靶点的表达丰度存在差异,即使靶点表达丰度相似,患者的遗传背景、肿瘤微环境等因素也会影响靶向药物的临床疗效。而且肿瘤内部不同细胞之间靶点表达也具有异质性,部分低表达靶点的细胞可能成为肿瘤复发和转移的根源,影响整体的临床疗效。
二、空间分布与可及性
细胞极性是大部分细胞都具有的基本性质,具体表现为细胞形态的不对称性以及胞内细胞器、蛋白质及核酸等组分的不对称分布,对于细胞的分化、发育与功能发挥起着举足轻重的作用,细胞极性的异常改变与发育缺陷、肿瘤生成及转移密切相关。无论是神经元、上皮细胞中长期维持的极性,还是细胞分化、迁移过程中涉及的瞬时极性,细胞极化的共性在于,一些极性调控蛋白质被特异地招募到指定膜区域,并发生显著的局部聚集。
1. 靶蛋白的极性分布
上皮细胞在组织中发生极化(如顶端vs基底膜,紧密连接蛋白),细胞的不同部分负责执行不同的功能。细胞表面分子 Claudin18.2 调节屏障特性并有助于细胞间粘附。它是细胞极性紧密连接和密封相邻细胞之间空间的关键组成部分。在正常组织中,Claudin18.2 的表达非常有限且在很大程度上无法接近,因为它通常隐藏在胃粘膜细胞的紧密连接复合物中。然而,在癌症的发展过程中,细胞会失去其极性和结构(见图2)。因此,Claudin18.2 可能在肿瘤发生过程中暴露出来,并可作为癌症治疗的靶点。Claudin18.2 在胃癌和胰腺癌细胞上高度表达,也可存在于食管癌、肺癌和卵巢癌中。其表达模式使 Claudin18.2 成为靶向癌症治疗的高选择性生物标志物[3]。同样,组织因子正常分布在血管外膜,在血管不被破坏的情况下,血液来源的分子很难触及或靶向结合,只有在肿瘤组织或炎症细胞才暴露,使药物分子可及。所以,这类特殊极性分布特点的靶蛋白的ADC或RDC药物对正常组织不会造成on-target毒性,安全性更高。
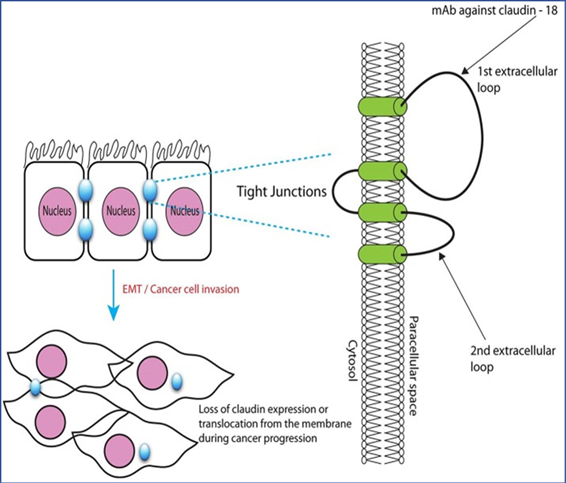
图2 Claudin 18.2在正常紧密连接中隐蔽,在肿瘤细胞失去极性后暴露,药物分子可及
2. 其他空间因素
除了靶蛋白的极性分布外,膜微区富集(如脂筏)和靶点动态变化(治疗诱导)等其他空间因素也会对靶点药物的疗效产生影响。1)某些受体(如EGFR)在脂筏中聚集,促进信号传导,靶向脂筏的药物(如胆固醇消耗剂)可增强疗效。2)靶点下调:EGFR-TKI治疗后EGFR内吞降解,降低药物敏感性。3)新表位暴露:化疗或放疗诱导肿瘤细胞表面钙网蛋白(CRT)暴露,增强免疫治疗应答。
三、肿瘤组织中靶点异质性和靶向药物的临床疗效的关系
肿瘤靶点异质性(Tumor Target Heterogeneity)是指在同一肿瘤组织内或不同病灶间,靶点蛋白的表达水平、突变状态或功能活性的空间或时间差异。有一些关于晚期结直肠癌和乳腺癌的研究表明,使用与分子靶标匹配的药物治疗可能并不总是能改善结局,这可以用多种因素来解释,包括肿瘤微环境的影响和肿瘤异质性。肿瘤内遗传异质性对个性化医疗方法具有重要意义,因为它会限制治疗效果并导致对治疗的耐药性。以下将从肿瘤靶点异质性的类型及其对临床疗效的影响、靶点异质性对临床疗效的影响机制两个方面展开分析。
1. 靶点异质性的类型及其对临床疗效的影响
1)肿瘤间异质性:是指不同肿瘤之间的细胞在基因和表型上存在差异。如PD-L1在肺癌(50%阳性)与三阴性乳腺癌(20%阳性)的差异,导致PD-1抑制剂响应率不同。这种异质性是导致靶向药物疗效下降、耐药性产生及肿瘤复发的重要原因。
2)肿瘤内异质性:是指同一肿瘤内靶点表达差异,又被分为空间异质性和时间异质性,这可能会导致耐药克隆逃逸(如BCMA CAR-T治疗后BCMA阴性复发)。①空间异质性:指的是相同类型的肿瘤内部,不同区域的细胞在基因和表型上存在差异。同一肿瘤内不同区域的细胞靶点表达差异(如EGFR在肺癌原发灶高表达,转移灶低表达)一般在60%左右,尤其在肿瘤的早期异质性更高。这种差异取决于用作检测分离材料来源的样品区域。在临床实践中,标本取自于外科手术或活检过程中获得的福尔马林固定石蜡包埋的肿瘤样本。这些样本的获得通常滞后于靶向治疗的适应症的确认。可以说,初始手术标本中原发肿瘤的分子谱可能与从转移部位活检获得的肿瘤标本中的分子谱显著不同,并且可能无法反映由于应用癌症疗法引起的选择压力而积累的分子畸变[4]。②时间异质性:是指与肿瘤进展相关的不同时间点的肿瘤靶点表达的异质性。通常肿瘤发生的早期或转移之前的肿瘤异质性要好得多。例如, 在前伊马替尼时代,慢性粒细胞白血病(CML)是一种致命的疾病,中位生存期为4年,同种异体干细胞移植是唯一的治疗方法。在对处于原始细胞危象(发作的急变期)的CML患者进行伊马替尼测试的临床研究阶段,结果普遍令人沮丧,反应率低于 15%,生存期通常不超过1年。真正产生影响的是将伊马替尼移至新诊断CML的一线治疗,从而中位生存期从4岁增加到 19-25岁。这表明治疗时机非常重,假设治疗转移性实体瘤等同于治疗 CML急变期,那么无法在这些患者中实现治愈或持久缓解也就不足为奇了。导致伊马替尼在CML中成功的主要因素,包括确定经过验证的分子靶点、开发或确定能够抑制靶点的靶向药物,并将其用于早期诊断的疾病[5]。早期癌症不太可能出现显著的异质性,也就可能减少治疗失败的概率。即使在新诊断的实体瘤中,通过适当选择的靶向治疗无法达到显著或持久的效果的情况下,也可以预期其疗效将超过目前在复发或难治性疾病。最后,与获得多种分子畸变的晚期癌症相比,在早期癌症中了解对靶向治疗的耐药性可能是一项不那么艰巨的任务。所以,寻找一些早期肿瘤高表达的靶点,并开发出针对的靶向药物是一个极具潜力的研究方向。 比如胃泌素释放肽受体 (GRPR) 是一种 G 蛋白偶联受体,已被研究为检测和治疗多种癌症类型(包括前列腺癌,PCa)的有吸引力的靶标。在 PCa 中,据报道 GRPR 过表达见于 63-100% 的病例。与 PSMA 相反,GRPR 过表达主要与原发早期的PCa有关。NeoBOMB1,是一种 GRPR 治疗诊断剂,已在临床前和初步临床研究中得到广泛验证,并取得了有希望的结果[6](见图3)。
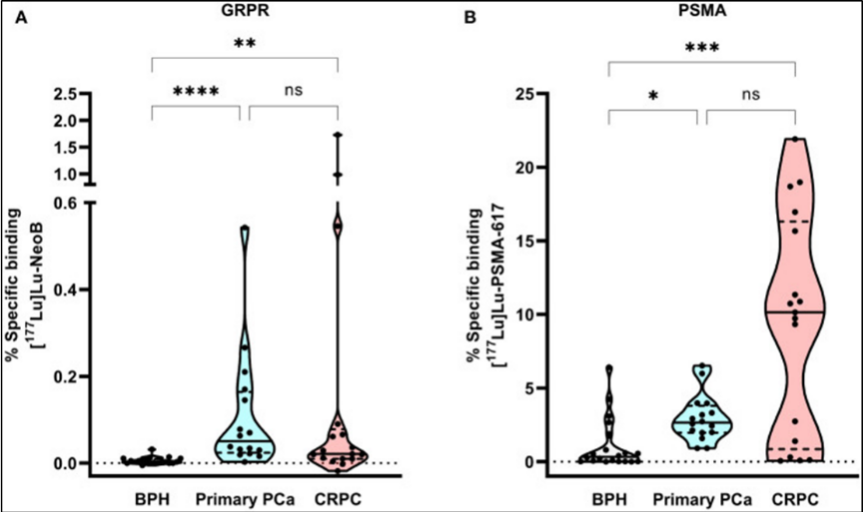
图3 胃泌素释放激素受体主要在原发早期Pca表达,而PMSA主要在晚期Pca表达
2. 靶点异质性对临床疗效的影响机制
1)疗效降低的直接原因:①靶点阴性克隆逃逸:若部分肿瘤细胞不表达靶点,药物无法杀伤这些细胞,导致残留病灶。案例:CD19 CAR-T治疗后,CD19阴性复发占30%-40%。②信号通路冗余:异质性导致替代通路激活(如MET扩增绕过EGFR抑制),使得肿瘤细胞能够继续生长和增殖,从而降低了药物的疗效。
2)耐药性产生的核心驱动因素:①预存耐药克隆:治疗前已存在耐药突变(如KRAS突变存在于部分结直肠癌细胞),这些耐药克隆在药物治疗过程中能够存活并继续增殖,导致耐药性的产生。②适应性耐药:药物压力下,肿瘤通过表型转换(如上皮-间质转化)下调靶点,使药物无法有效作用于肿瘤细胞,进而产生耐药性。
四、前景与挑战
靶向细胞膜蛋白的抗肿瘤药物为癌症患者带来了前所未有的治疗希望,显著改善了部分癌症的治疗效果。然而,这类药物在应用中仍面临一些挑战。一方面,肿瘤细胞具有高度异质性,部分肿瘤细胞可能通过改变细胞膜蛋白表达或激活其他旁路信号通路来逃避药物的攻击,导致耐药性的产生。另一方面,虽然靶向药物相较于传统化疗药物副作用较小,但仍可能引发一些不良反应,如免疫治疗相关的免疫性肺炎、内分泌紊乱等,以及小分子抑制剂导致的皮疹、腹泻等。
展望未来,随着对肿瘤生物学机制研究的不断深入,科学家们将开发出更多高特异性、低耐药性的靶向药物。同时,靶向药物与免疫治疗药物联合及不同靶向药物联合等联合治疗策略,有望进一步提高癌症治疗效果,为最终攻克癌症这一全球性难题带来新的希望。抗肿瘤药物靶向细胞膜蛋白的抗肿瘤药物开发已从单一抗体迈向“精准降解+智能递送”的2.0时代。通过整合ADC、双抗、CAR-T和蛋白降解技术等突破递送瓶颈,未来有望实现更高选择性的肿瘤杀伤,尤其为实体瘤和耐药患者提供新解决方案。随着AI与合成生物学的深度融合,个体化膜蛋白靶向疗法或将成为肿瘤治疗的下一个里程碑。
参考文献
- 1.Zhao, Y., et al., A mini-overview of antibody-drug conjugates in platinum-resistant ovarian cancer: A preclinical and clinical perspective. Int J Biol Macromol, 2025. 304(Pt 2): p. 140767.
- 2.Yoon, J. and D.Y. Oh, HER2-targeted therapies beyond breast cancer - an update. Nat Rev Clin Oncol, 2024. 21(9): p. 675-700.
- 3.Kumar, V., et al., Emerging Therapies in the Management of Advanced-Stage Gastric Cancer. Front Pharmacol, 2018. 9: p. 404.
- 4.Janku, F., Tumor heterogeneity in the clinic: is it a real problem? Ther Adv Med Oncol, 2014. 6(2): p. 43-51.
- 5.Westin, J.R. and R. Kurzrock, It's about time: lessons for solid tumors from chronic myelogenous leukemia therapy. Mol Cancer Ther, 2012. 11(12): p. 2549-55.
- 6.Verhoeven, M., et al., GRPR versus PSMA: expression profiles during prostate cancer progression demonstrate the added value of GRPR-targeting theranostic approaches. Front Oncol, 2023. 13: p. 1199432.
*声明:本文仅是介绍医药疾病领域研究进展或简述研究概况或分享医药相关讯息,并非也不会进行治疗或诊断方案推荐,也不对相关投资构成任何建议。



