针对PSMA靶点的放射性核素药物的内卷逻辑
发布时间:
2025-02-17
作者:
汤俊颖,中晟全肽研发战略部研究员
引言
自2021年,以司美格鲁肽为代表的GLP-1类减肥药在美国获批以来,就立即在世界范围内刮起一阵减肥旋风,各大药企纷纷布局,在疗效、靶点、剂型、适应症等多个维度展开深度竞争。这一现象深刻反映出,在医药研发飞速发展的当下,针对成功靶点的药物开发内卷已成为行业常态。在肿瘤精准诊疗这一细分领域,放射性核素偶联药物(Radionuclide Drug Conjugates,RDC)异军突起,成为备受瞩目的焦点。其中,诺华的Pluvicto 表现尤为亮眼。自2022年上市以来,其商业化成绩斐然,上市当年便实现2.7亿美元的收入。到了2023年,更是一跃成为全球年销售额最高的放射性治疗药物,稳稳预定“重磅炸弹药物”俱乐部的席位。目前,RDC 成功靶点稀缺,而 PSMA RDC的成功让众多药企和科研机构敏锐捕捉到其蕴含的巨大潜力与商业价值,纷纷投身于该靶点RDC的开发。此外,PSMA会在唾液腺细胞中表达,使用Pluvicto 有≥20%的概率会引发口干症等副反应,同时还存在响应率、适应症局限等问题。综合以上因素,一场针对 PSMA 靶点 RDC 药物开发的内卷风暴在全球范围内全面掀起。本文将从RDC的结构组成入手,深入剖析 PSMA RDC药物的内卷逻辑,探究这一现象背后的原因,明确其影响,并寻求切实可行的应对策略。
1、国内外靶向PSMA放射核药开发现状
截至目前,据不完全统计,全球靶向PSMA的放射核素药物有6种批准上市,处于临床阶段的RDC共有67种。其中,用于诊断的RDC为36种(见表1),用于治疗的RDC为 37种(见表2)。已上市的 6 种 RDC 药物中,有 5 种用于诊断,仅有 1 种用于治疗。这主要是因为 PSMA 在几乎所有的前列腺癌(prostate cancer,PCa)细胞膜中显著上调,使得放射性同位素能够精准导向表达 PSMA 的前列腺癌细胞,在极短半衰期内给出信号,并通过分子影像学得出全面的医学影像结果。而且,诊断时使用的放射性核素剂量相对较低,在确保能够产生足够成像信号的同时,对人体造成的辐射危害处于可接受范围内,能较好地满足临床需求。另外,治疗用 PSMA RDC 在技术难度上更为复杂,不仅要考虑靶向性,还需精确选择放射性同位素并严格控制其剂量和辐射范围,以确保在有效杀死肿瘤细胞的同时,尽可能减少对周围正常组织的损伤。不过,从临床阶段 RDC 类型数据可以明显看出,越来越多的治疗用 PSMA RDC 进入临床,这充分表明诺华 Pluvicto 的成功以及它尚未满足的临床缺口,极大地激发了企业和科研机构对这一领域的开发热情。
表1 靶向PSMA的诊断型放射性核素药物
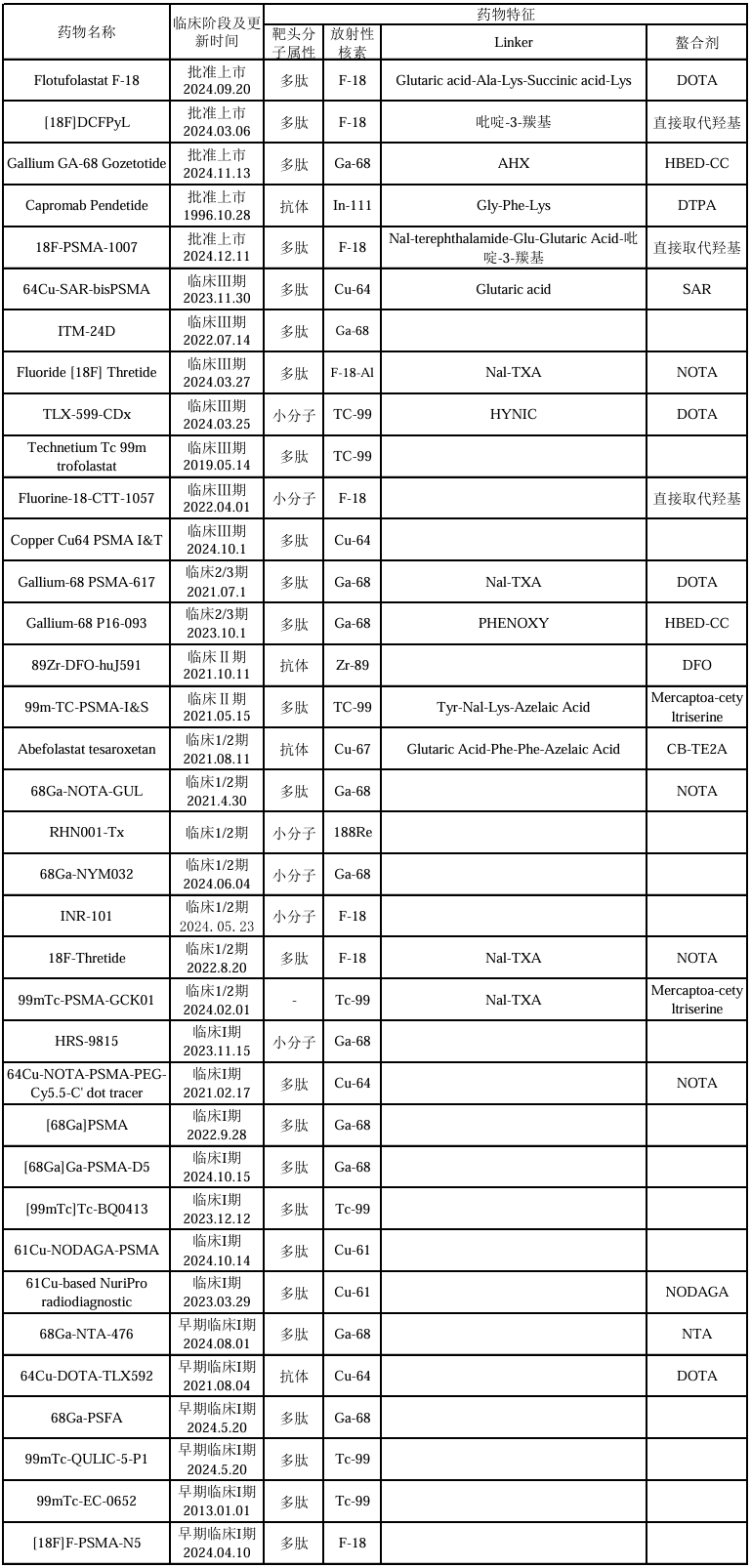
表2 靶向PSMA的治疗型放射性核素药物
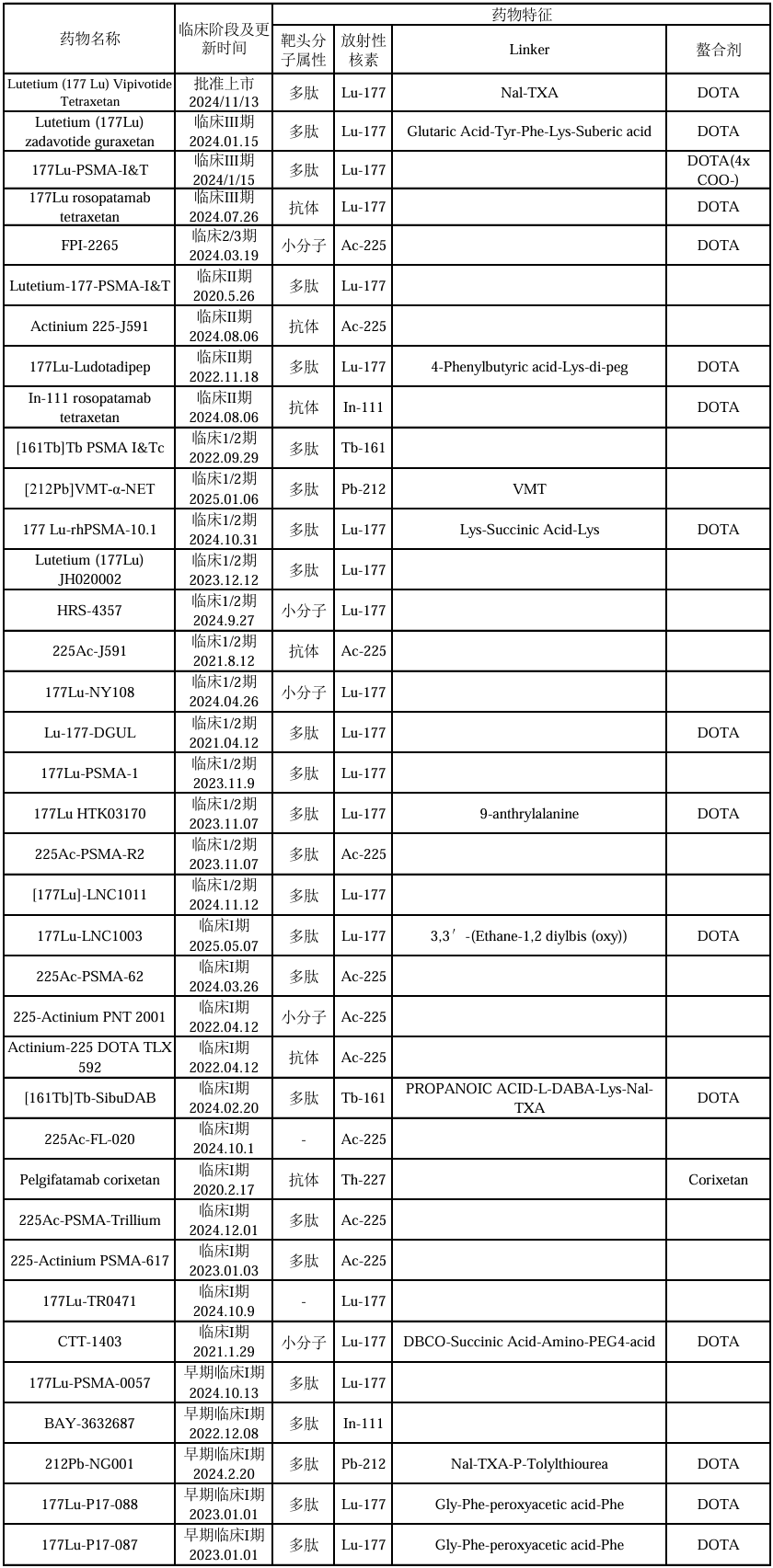
(注:表中信息源自智慧芽新药情报库,收集信息截止时间2025年1月15日)
2、靶头由抗体向小分子多肽的转变
ProstaScint™作为第一个商业化的 PSMA RDC,于 1996 年获得美国 FDA 批准,用于 PSMA 的 SPECT 诊断。它以7E11单克隆抗体为靶头,与 PSMA 的细胞内结构域结合(见图1)。在初始分期检测中,其效果优于传统成像,灵敏度为 52 - 62%,特异性为 72 - 96%[1]。然而,该抗体存在明显局限性,它通常只对坏死或凋亡细胞显影。由于亲水性强,分子体积庞大(≈150kDa),无法穿透活细胞的疏水膜,所以在肿瘤组织中显影较差[2]。因此,在临床上,ProstaScint™由于药代动力学不佳和无法到达 PSMA 上的靶表位,在获得批准后其应用受到了极大限制。
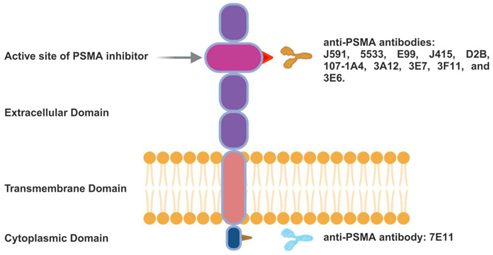
图1 单克隆抗体7E11的PSMA结合部位
鉴于初始抗 PSMA mAb(7E11)因靶向PSMA胞内结构域和分子量过大影响显影效果,研发人员将目光转向靶向PSMA胞外结构域以及分子量小的PSMA抗体。第一个成功应用的人源化 mAb 是 J591。据报道,89Zr - J591 在骨组织和软组织病变诊断的总体准确率分别为 95.2% 和 60%,成像效果明显,但注射后最佳成像时间为 6 - 7 天。为了缩短成像时间,随后研发出用 89Zr 标记的微型抗体(Df - IAB2M;分子量:≈80 kDa)。通过基因工程去除 Fc 受体结构域,形成小体,实现了更快的血液清除,从而将成像时间缩短到注射后 48 小时[3]。优化单克隆抗体药代动力学的常见策略是缩小抗体整体尺寸,生成对表位亲和力保持不变的抗体片段,如纳米抗体。纳米抗体为15 kDa 的抗体衍生片段(通常是重链抗体的可变结构域),在很大程度上保留了与特异性抗原结合的特性,具有更快的药代动力学和更低的免疫原性[4]。虽然改良抗体的分子量减少,使得疗效取得了一定进步,但分子量仍然未降到理想状态,仍存在肿瘤穿透性差和从正常组织清除缓慢的问题。
与抗体相比,低分子量的靶头优势巨大,能够更快速、更有效地穿透肿瘤组织,提高药物在肿瘤细胞内的富集程度,这也是在临床阶段以多肽为靶头的PSMA RDC显著多于单克隆抗体的原因(见图2)。2005年,PSMA 晶体结构的解析为靶向PSMA多肽的相关研究带来了新的契机[5]。PSMA 是一种金属肽酶,研究人员最初将重点放在合成含有已知能抑制金属肽酶的官能团的小分子上,如 2-PMPA(见图3)。2-PMPA 通过膦酸基与 PSMA 锌离子活性位点结合,其抑制能力比以前描述的抑制剂强 1000 倍以上,但渗透血脑屏障进入大脑的能力有限。因此,为提高亲脂性和药代动力学特征,以 2-PMPA 为模板进行了一系列尝试。最终发现,要开发出有效的 PSMA 抑制剂,至少有两个特征是必不可少的:一个是与酶活性位点相互作用的强锌结合基团,另一个是 PSMA 口袋结合的谷氨酸残基。这一发现引发了以谷氨酸 - 脲类为靶头的研发竞争。由于许多放射性卤代基团可以通过 ε 氨基连接,最终以 Lys - urea - Glu 为靶头成为主流。随着Pluvicto VISION数据响应率不足和口干症不良反应的发生,研究人员期望通过改变 Lys - urea - Glu 靶头结构来降低放射性核素在唾液腺的摄取,如添加血浆蛋白结合域,延长放射性标记示踪剂的循环时间,减少对正常器官的摄取。可以预见,随着科学的持续进步和医学诊疗手段的不断革新,靶向 PSMA 分子探针的开发将继续朝着高敏感度、高特异性、少副反应及低成本的目标稳步迈进。
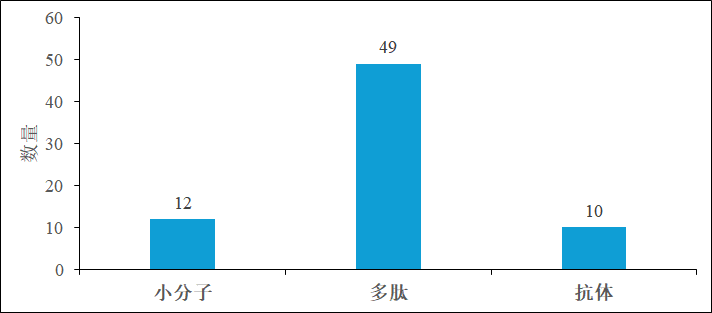
图2 靶向PSMA RDC的靶头类型
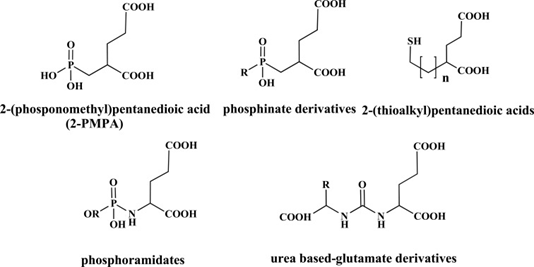
图3 PSMA小分子配体主要类别的化学结构
3、放射性核素的选择与竞争
在核医学领域,放射性同位素诊断成像技术发挥着至关重要的作用,其中单光子发射计算机断层成像(SPECT)和正电子发射断层成像(PET)是两种常用的技术手段。这两种技术各有特点,在临床应用中有着不同的表现。
在PSMA SPECT 技术中,ProstaScint™率先崭露头角,采用111In作为放射性核素,用于前列腺癌的诊断。然而,111In存在半衰期长、分辨率低的不足,于是需要积极探索更合适的放射性核素。目前,处于临床阶段的靶向 PSMA RDC 中,有 8 种选用99mTc 作为放射性核素。99mTc具有诸多优势,其半衰期约为 6 小时,在成像过程中,较短的半衰期意味着放射性药物在体内停留时间缩短,从而有效减少了辐射对人体造成的潜在危害。此外,99mTc的生产方式相对简单,成本也更低,在 SPECT 临床市场中占有率高达 80%,这为相关药物的研发提供了更有利的条件。
相较于SPECT,PET/CT 具有更高的分辨率,能够更清晰地显示微小病灶,实现精准定位。PET/CT在肿瘤诊治领域的临床应用占比达80%。用于PET/CT 的核素以68Ga和18F最为常见(见图4)。
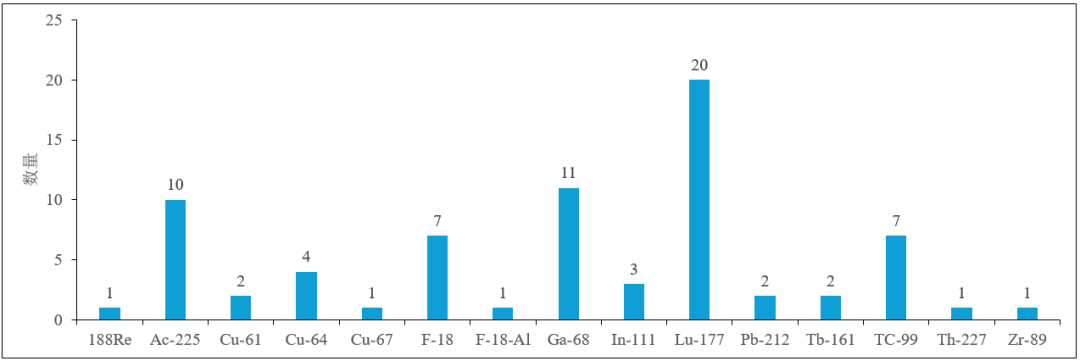
图4 PSMA的放射性核素药物临床阶段的核素类型和数量
然而,当我们进一步分析全球获批的所有RDC药物中PET/CT核素的占有率[6](见图5)时,会发现一个有趣的现象:18F的占有率高达65%,而68Ga仅为 15%,两者相差悬殊。但在 PSMA RDC的研发过程中,更多的公司和科研机构却倾向于68Ga。背后的原因主要有以下几点:
- 1、18F -FDG 是应用最为广泛的PET/CT示踪剂,但由于前列腺癌的糖酵解率相对较低,它在前列腺癌诊断中表现欠佳,无法满足精准诊断的需求。
- 2、有文献研究表明,诊断药物代表,18F -PSMA-1007 在良性病变中的摄取率几乎是68Ga -PSMA-11的五倍[7],并且其PET成像中良性病变的 SUVmax更高。这表明18F -PSMA-1007 PET 检查的假阳性率较高,不利于前列腺癌的精准诊断。
- 3、在诊断准确性方面,UCLA/UCSF(加利福尼亚大学) 使用68Ga -PSMA-11 的阳性预测值(Positive Predictive Value, PPV) 为92%,而用于生化复发前列腺癌的 Ⅲ 期多中心前瞻性研究18F -DCFPyL 的正确定位率为 85%-87%。这些数据直观地显示出68Ga对 PSMA 靶向前列腺癌的诊断准确性更高。
- 4、当 PSA水平较低时,68Ga -PSMA-11对复发性前列腺癌的检出率较高,能够帮助医生更及时地发现疾病复发情况。
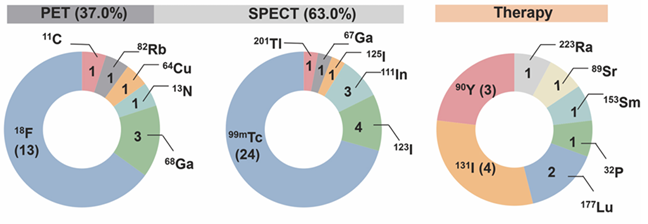
图5 全球67种获批的放射性药物的核素分类和占比
值得关注的是,近年来 PET/CT 的核素选择更加多元化,现有4 种PSMA RDC是以 64Cu 为放射性核素。从64Cu的天然属性分析,其半衰期为 12.7h,远远长于68Ga和18F的 1 - 2 小时,这使得在诊断检测操作中无需像使用68Ga 和18F那样争分夺秒,医院终端和患者在诊断时可以更加从容。然而,64Cu最大的问题在于螯合,对于普通的常规螯合剂,Cu 非常容易泄露出来,从而带来极大的安全性隐患。所以,如何在诊断前列腺癌时实现更高分辨率、更准确、更安全,是核素选择的重要方向。
放射性核素疗法的设计目标是将集中吸收的辐射剂量传递给靶细胞,同时最大程度地保护周围的健康组织。为了延长放射治疗剂的治疗效果,研发人员通常会选用半衰期较长(从几天到大约一到两周)的放射性核素。β核素因其具有合适的半衰期和良好的理化特性,成为临床上最常用的治疗性放射性核素[8]。部分β核素(如Lu-177)因为其能同时发射γ射线,所以能够用SPECT成像检测和评估疗效。这一特性使得医生可以及时对肿瘤治疗后的效果进行评估,同时减少二次注射诊断型 RDC 对人体造成的危害。例如,在 β核素中,90Y虽相比 177Lu具有更强的穿透力,但由于它无法发射伽马射线,目前临床阶段靶向 PSMA 的 RDC 在研药物中并未包含90Y。在实际治疗中,当使用 177Lu - PSMA - 617进行治疗时,通常会先运用 68Ga - PSMA - 11 进行诊断确诊,这里的 PSMA - 11 和 PSMA - 617 是两种不同的分子架构。而 67Cu 由于与同家族的64Cu 结构类似,可以共用同一分子,从而为治疗提供更好的匹配,在应用上更为便利。
尽管 β 放射性核素在肿瘤治疗领域的发展程度相对较高,但仍存在一些问题。有文献报道,约30%的转移性去势抵抗性前列腺癌患者从未对177Lu - PSMA - 617治疗产生反应。这一现状促使越来越多的公司和科研机构将目光投向 α 放射性核素,将其作为新的研究竞争方向。目前,已有 13 种 α 放射性核素 PSMA RDC 进入临床阶段,其中包括 10 种 225Ac、2 种 212Pb、1 种 227Th。仅在 2025 年,就已知有 3 家公司布局 α 放射性核素相关研究。α 放射性核素具有诸多显著优势:
- 1、电离能力强,这使得它在杀伤癌细胞时效率更高,能够更有效地破坏癌细胞结构和功能。
- 2、穿透能力弱,普通医用手套即可达到防护效果,这一特性使得它可以进行门诊给药。与之对比,β 射线则需要专业防护设施和装备进行有效防护,患者给药期间需要住院。在癌细胞内造成 DNA 损伤时不会波及相邻细胞,从而将对周围正常组织的副作用降至最低。
在众多 α 核素中,225Ac是目前研究与开发的热点。一项试验显示,225Ac - PSMA - 617 能够使经 177Lu - PSMA - 617 治疗后无效的转移性去势抵抗性前列腺癌患者产生治疗效果[9],且副作用极小。因此,当肿瘤中表达 PSMA 时,225Ac - PSMA - 617 可应用于治疗的任何阶段。值得关注的是,225Ac - PSMA - 617 还可用于转移性激素敏感性前列腺癌(mHSPC)的治疗。据文献报道,在少数病例中,接受 225Ac - PSMA - 617 治疗的 mHSPC 患者 PSA 水平显著下降[10]。然而,225Ac 核素原料在全球范围内的供应极为有限,现有的生产供应水平无法满足该核素产品商业化的需求。在这样的背景下,212Pb 逐渐受到关注并得到使用。212Pb在衰变过程中只发射一个α粒子,因此杂散辐射的风险较小。同时,它还可以与伽马射线发射同位素203Pb 配对,适用于成像。不过,212Pb的半衰期仅为 11 小时,这给物流和运输带来了巨大挑战,限制了其更广泛的应用。
综上所述,在选择用于临床使用的放射性核素时,需要综合考虑多方面因素。除了关注治疗效果和核素本身的特性外,市场需求上升、成本和可获得性等因素也不容忽视。合适的放射性核素的选用是至关重要的,这样可以确保放射性核素的物理性质与配体的药代动力学性质相匹配,在选择合适的适应症人群,从而实现放射药物取得高效低毒,达到精准靶向抗肿瘤目的。
4、连接子和螯合剂的竞争与优化
有文献报道称,连接子和螯合剂的修饰会对 PSMA 靶向小分子抑制剂的结合亲和力、生物分布和整体药代动力学特性产生重大影响。2020年,68Ga - PSMA - 11 获得 FDA 批准,用于复发性前列腺癌的 PET/CT 诊断成像。它以 HBED - CC 为螯合剂,氨基己酸为连接子,在室温条件下就能与68Ga发生络合,这一特性极大地简化了药物的制备过程,减少了药物生产成本。68Ga - PSMA - 11 展现出显著的优势,能够潜在地检测前列腺癌中非常小的转移灶,并且能从非目标组织中快速清除,主要通过肾脏排泄。不过,这种排泄方式也带来了一些问题,它会导致泌尿道过度显像这可能会将输尿管的局灶性活动误认为是病理性淋巴结摄取,膀胱异常摄取也可能干扰前列腺的临床评估。
回顾 RDC 药物的研发历程,可以发现研发人员普遍倾向于设计只需更换放射性核素就能达到治疗效果的分子结构。这种设计思路不仅能提高研发效率,还能降低研发成本。然而,在 PSMA - 11 中使用的 HBED - CC 螯合剂存在局限性,它不能与 177Lu形成足够稳定性的复合物,所以无法在体内进行应用。这一难题促使科研人员展开激烈竞争,致力于使177Lu和 Lys - urea - Glu 之间形成稳定连接,以治疗去势抵抗性前列腺癌(mCRPC)。在这场竞争中,177Lu - PSMA - 617 和177Lu-PSMA - I&T 脱颖而出。二者的主要区别在于螯合剂的不同,PSMA - 617 的螯合剂是 DOTA,而 PSMA - I&T 的螯合剂在 DOTA 基础上增加了一个羧基(DOTAGA),这使得 PSMA - I&T 所带负电荷比 PSMA - 617 多。带负电荷的螯合剂可增加肾脏近端小管对配体的重吸收,因此导致 PSMA - I&T 肾脏吸收的剂量更高。此外,PSMA - I&T 在 DOTAGA - FFK(第一代 PSMA - I&T)(见图6)的基础上,对连接子氨基酸的构象进行了改变,从而提高了亲和力和内吞作用[11]。
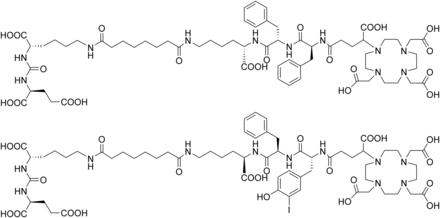
图6 第一代示踪剂 DOTAGA-FFK(Sub-KuE)(上图)和第三代示踪剂 PSMA I&T(下图)的化学结构
5、总结
PSMA肿瘤特异性标志蛋白被确认后,其RDC药物研发领域展开了激烈的竞争,尤其是诊断和治疗的PSMA RDC的获批上市之后,仍未显衰减趋势。许多著名核药公司参与其中。靶头由抗体向小分子多肽的转变,我们看到研发方向正朝着更高效、更具针对性的方向发展。应对未来趋势,首先应持续优化多肽靶头,深入挖掘其潜力,提升对肿瘤细胞的特异性识别与结合能力;其次应对β核素药物的疗效不足,用α核素替代β核素,研发新的高效低毒,适应广泛的PMSA α核素药物是重点;最后连接子和螯合剂的竞争与优化也为我们指明,通过对其结构的精细调整,有望改善药物的整体性能,提高治疗效果并降低副作用。展望未来,随着不断探索和创新,PSMA RDC 的开发必将取得更大突破。
参考文献
- 1.Lamb HM, Faulds D. Capromab pendetide. A review of its use as an imaging agent in prostate cancer. Drugs Aging. 1998 Apr;12(4):293-304.
- 2.Pastorino S, Riondato M, Uccelli L, Giovacchini G, Giovannini E, Duce V, et al. Toward the discovery and development of PSMA targeted inhibitors for nuclear medicine applications. Curr Radiopharm. 2020;13:63–79.
- 3.Pandit-Taskar N., O’Donoghue J.A. First-in-Human Imaging with 89Zr-Df-IAB2M Anti-PSMA Minibody in Patients with Metastatic Prostate Cancer: Pharmacokinetics, Biodistribution, Dosimetry, and Lesion Uptake. J. Nucl. Med. 2016;57:1858–1864.
- 4.Evazalipour M, D'Huyvetter M, Tehrani BS, Abolhassani M, Omidfar K, Abdoli S, Arezumand R, Morovvati H, Lahoutte T, Muyldermans S, Devoogdt N. Generation and characterization of nanobodies targeting PSMA for molecular imaging of prostate cancer. Contrast Media Mol Imaging. 2014 May-Jun;9(3):211-20.
- 5.Davis M.I., Bennett M.J., Thomas L.M., Bjorkman P.J. Crystal structure of prostate-specific membrane antigen, a tumor marker and peptidase. Proc. Natl. Acad. Sci. USA. 2005;102(17):5981–5986.
- 6.Zhang S, Wang X, Gao X, Chen X, Li L, Li G, Liu C, Miao Y, Wang R, Hu K. Radiopharmaceuticals and their applications in medicine. Signal Transduct Target Ther. 2025 Jan 3;10(1):1.
- 7.Rauscher I, Krönke M, König M, Gafita A, Maurer T, Horn T, Schiller K, Weber W, Eiber M. Matched-Pair Comparison of 68Ga-PSMA-11 PET/CT and 18F-PSMA-1007 PET/CT: Frequency of Pitfalls and Detection Efficacy in Biochemical Recurrence After Radical Prostatectomy. J Nucl Med. 2020 Jan;61(1):51-57.
- 8.Sallam M, Nguyen NT, Sainsbury F, Kimizuka N, Muyldermans S, Benešová-Schäfer M. PSMA-targeted radiotheranostics in modern nuclear medicine: then, now, and what of the future? Theranostics. 2024 May 13;14(8):3043-3079.
- 9.Kratochwil C, Bruchertseifer F, Giesel FL, Weis M, Verburg FA, Mottaghy F, Kopka K, Apostolidis C, Haberkorn U, Morgenstern A. 225Ac-PSMA-617 for PSMA-Targeted α-Radiation Therapy of Metastatic Castration-Resistant Prostate Cancer. J Nucl Med. 2016 Dec;57(12):1941-1944.
- 10.Banda A, Privé BM, Allach Y, Uijen MJM, Peters SMB, Loeff CC, Gotthardt M, Muselaers CHJ, Witjes JA, van Oort IM, Sedelaar JPM, Westdorp H, Mehra N, Khreish F, Ezziddin S, Sabet A, Kreissl MC, Winkens T, Seifert P, Janssen MJR, van Gemert WAM, Nagarajah J. PSMA-RLT in Patients with Metastatic Hormone-Sensitive Prostate Cancer: A Retrospective Study. Cancers (Basel). 2022 Dec 31;15(1):297.
- 11.Weineisen M, Schottelius M, Simecek J, Baum RP, Yildiz A, Beykan S, Kulkarni HR, Lassmann M, Klette I, Eiber M, Schwaiger M, Wester HJ. 68Ga- and 177Lu-Labeled PSMA I&T: Optimization of a PSMA-Targeted Theranostic Concept and First Proof-of-Concept Human Studies. J Nucl Med. 2015 Aug;56(8):1169-76.
*声明:本文仅是介绍医药疾病领域研究进展或简述研究概况或分享医药相关讯息,并非也不会进行治疗或诊断方案推荐,也不对相关投资构成任何建议。



