多肽偶联药物(PDC)的最新进展
发布时间:
2025-01-09
作者:
李福燕,中晟全肽研发战略部研究员
引言
多肽偶联药物(Peptide-drug conjugates, PDC)被定义为通过特殊的连接子将药物与多肽序列共价连接在一起的一种药物,由归巢肽、连接子和细胞毒性有效载荷三部分组成(见图1)[1]。广义上PDC的有效载荷包括:化疗药物、放射性核素和显影剂,本文提及的PDC是特指有效载荷为化疗药物。PDC的作用机制是:首先,归巢肽特异性靶向结合肿瘤细胞表面过表达的蛋白受体, 通过受体介导的内化作用递送细胞毒素进入肿瘤细胞。然后,连接子在细胞内或在肿瘤环境中的酶或特殊化学条件作用下(如肿瘤间质的低pH)断裂,释放出裸药,完整发挥其肿瘤杀伤作用(见图2)[2]。PDC是继抗体药物偶联物(Antibody-drug conjugates, ADC)之后的下一代靶向抗肿瘤药物。PDC药物与ADC药物结构类似,PDC整合了多肽的优势,与ADC药物相比,PDC药物分子量更小,且具有强力的肿瘤穿透性,免疫原性较低;另外与抗体生产的复杂工艺过程相比,PDC更易合成与纯化,生产成本较低。因此,PDC是继ADC之后最有希望取得治疗突破的偶联药物。所以了解PDC的发展趋势,洞察PDC未来的开发方向是很有必要的。本文通过分析临床进展靠前的PDC药物,总结PDC的最新研发进展,以期突出当前PDC的发展趋势和未来的发展方向。

图1 PDC的重要组成部分
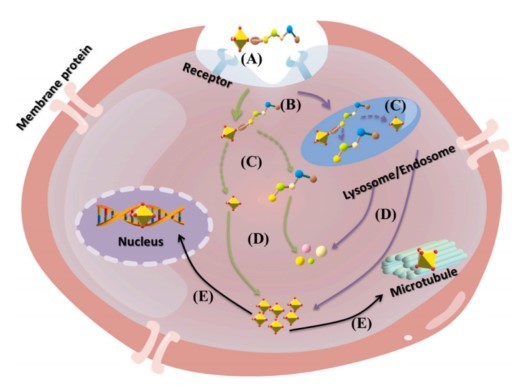
图2 PDC的作用机制。(A)与靶细胞表面抗原结合。(B)受体介导的内吞作用。(C) 在溶酶体或细胞质中分散。(D) 药物在细胞内释放。(E) 药物作用于微管等特定部位,导致肿瘤细胞死亡
1、背景
1910年,Paul Ehrlich提出了“Magic Bullet”(魔法子弹)理论,旨在描绘一种可以选择性地杀死恶性细胞而不伤害正常组织的药物的概念,即借助这些“子弹”可将药物输送到特定部位。由于常规化疗药的选择性差,会带来的以骨髓抑制为主的毒副作用,所以限制了其在临床的抗肿瘤效果。为了提高化疗药的选择性,以特异性单克隆抗体药物为基础,提出了ADC这个新概念。1957年,Mathé首次将甲氨蝶呤与抗白血病1210抗原免疫球蛋白偶联用于治疗白血病,由此拉开了药物偶联物的研究序幕。ADC作为药物偶联物的最初并且是最典型的代表,以抗体作为载体,形成抗体-药物偶联物,将抗体和细胞毒性药物(有效载荷)递送到癌细胞[3]。到目前为止,全球获批上市的ADC药物数量已多达16个。虽然ADCs在临床应用中取得了显著成效,但是也面临着耐药性的出现、药代动力学复杂、有效载荷释放无效等问题,许多这些问题都与单抗的成分有关。鉴于此,改进靶向治疗的一种思路是放弃传统单克隆抗体的结构,选择将毒性试剂与分子量小的多肽偶联,生成新型靶向治疗药物,即PDCs [4]。下面将讨论ADC疗法的一些缺陷,并提出PDCs可以弥补这些缺陷的方法(见表1)[5]。
表1 ADC与PDC的对比
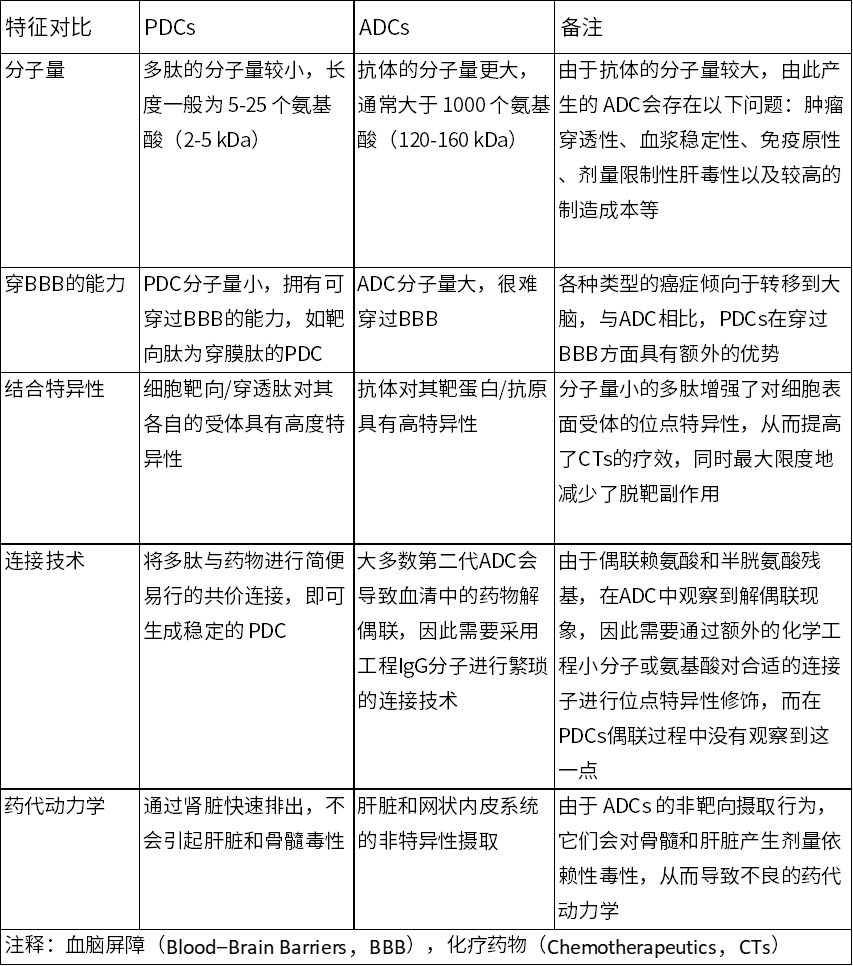
首先抗体分子量大,无法在肿瘤细胞间质上自由扩散,不能够将这些大分子渗透到离血管更远的肿瘤组织,使得药物的覆盖有限,从而限制其抗肿瘤效果;相反,PDC分子量较小的本质,可以使得多肽在肿瘤间质的分布要高于抗体药物。此外,多肽分子体积小具备穿透肿瘤基质进入肿瘤细胞的能力[6]。ADC开发的另一个局限性是可用于连接抗体和小分子有效载荷的共轭化学反应范围较窄[7],而PDC的短肽特性使其结构更加灵活,更容易修饰和共轭,可与化学药、蛋白药、多肽药等多种药物偶联制备靶向药物,大大提高了PDC制剂平台技术的可行性。此外肽片段的生产工艺简单,易于规模化生产,有效降低了制药成本[8]。此外,ADC在人体内可诱导免疫反应产生抗药抗体,这可能会对身体产生免疫原性副作用[9]。而多肽具有高度生物降解性,具有较低的免疫原性,在患者体内引发的免疫反应较小[10]。ADC本身可能并不比作为有效载荷的细胞毒性药物更有效,有时需要极高的剂量才能发挥作用,并且有数据表明只有很小一部分肿瘤靶向单克隆抗体的给药剂量到达肿瘤组织(约0.1%),这意味着需要细胞毒性更强的有效载荷才能达到疗效。而PDC则没有这一限制,其细胞毒性药物的选择面更广泛,由于较强的肿瘤组织渗透性,PDC药物能够在靶标处累积达到高浓度,从而高效地杀伤肿瘤细胞。因此PDC可以选择阿霉素、紫杉醇等毒性相对较低且普遍应用于临床的化疗药物作为PDC的毒性弹头,载药量也更高[11]。
基于上述所有的优势,PDC有望成为继ADC药物之后的新一代抗肿瘤药物。
2、PDC的最新研究进展
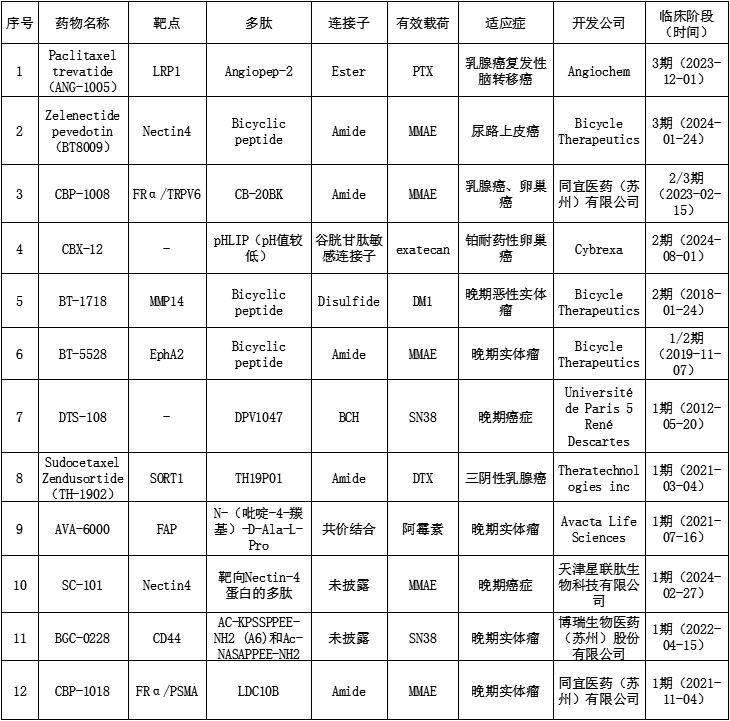
近年来,随着蛋白质组学、噬菌体展示技术、mRNA展示技术和固相多肽合成等技术的快速发展,越来越多的新肽被发现或合理设计,极大地促进了PDC的发展,越来越多的药物进入临床阶段(见表2)。目前在研的处于临床阶段的PDC药物总共有12个,适应症均与癌症相关,有效载荷大部分为MMAE,连接子大部分为Amide,这些药物均仍处于积极开发状态。目前临床进展最快的药物是Paclitaxel trevatide(ANG-1005)和Zelenectide pevedotin(BT8009),均处于临床3期,下一节将重点介绍这两个药物的具体情况。
表2 处于临床阶段的PDC
3、临床进展靠前的优秀药物分析
3.1 ANG1005的研究现状
目前全球进展最快的PDC是由加拿大的Angiochem开发的ANG1005,ANG1005是一种创新靶向肿瘤的紫杉烷衍生物,即Angiopep-2紫杉醇偶联物,是首个利用Angiochem技术平台穿越血脑屏障(BBB)进入癌细胞的药物。通过将识别LRP-1受体的多肽与紫杉醇连接,促进药物进入大脑和肿瘤细胞(见图3)。目前ANG1005已在美国和加拿大完成II期临床试验,用于治疗乳腺癌软脑膜转移的III期临床试验方案已获FDA批准,在美国和加拿大同步开展,国内盛诺基获得了Paclitaxel trevatide的在大中华区发展和商业化的专有权。
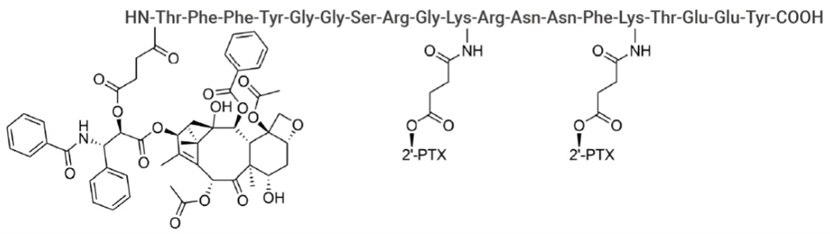
图3 ANG1005的结构图
一项关于ANG1005治疗乳腺癌脑转移的Ⅱ期临床的试验(NCT01480583),共入组72例患有复发性乳腺癌脑转移的女性患者,研究显示,经ANG1005治疗的乳腺癌脑转移患者颅内和颅外临床获益率分别为77%和86%(见图4),乳腺癌脑转移患者的颅内总体ORR为15%,颅内临床获益率为68%。在软脑膜癌病亚群中,79%的患者颅内疾病得到控制,中位总生存期预估为8.0个月(95% CI, 5.4-9.4)(见图5)。该药物的成功证明PDC分子量小,容易穿透肿瘤细胞甚至是BBB,从而发挥治疗肿瘤的效果[12]。
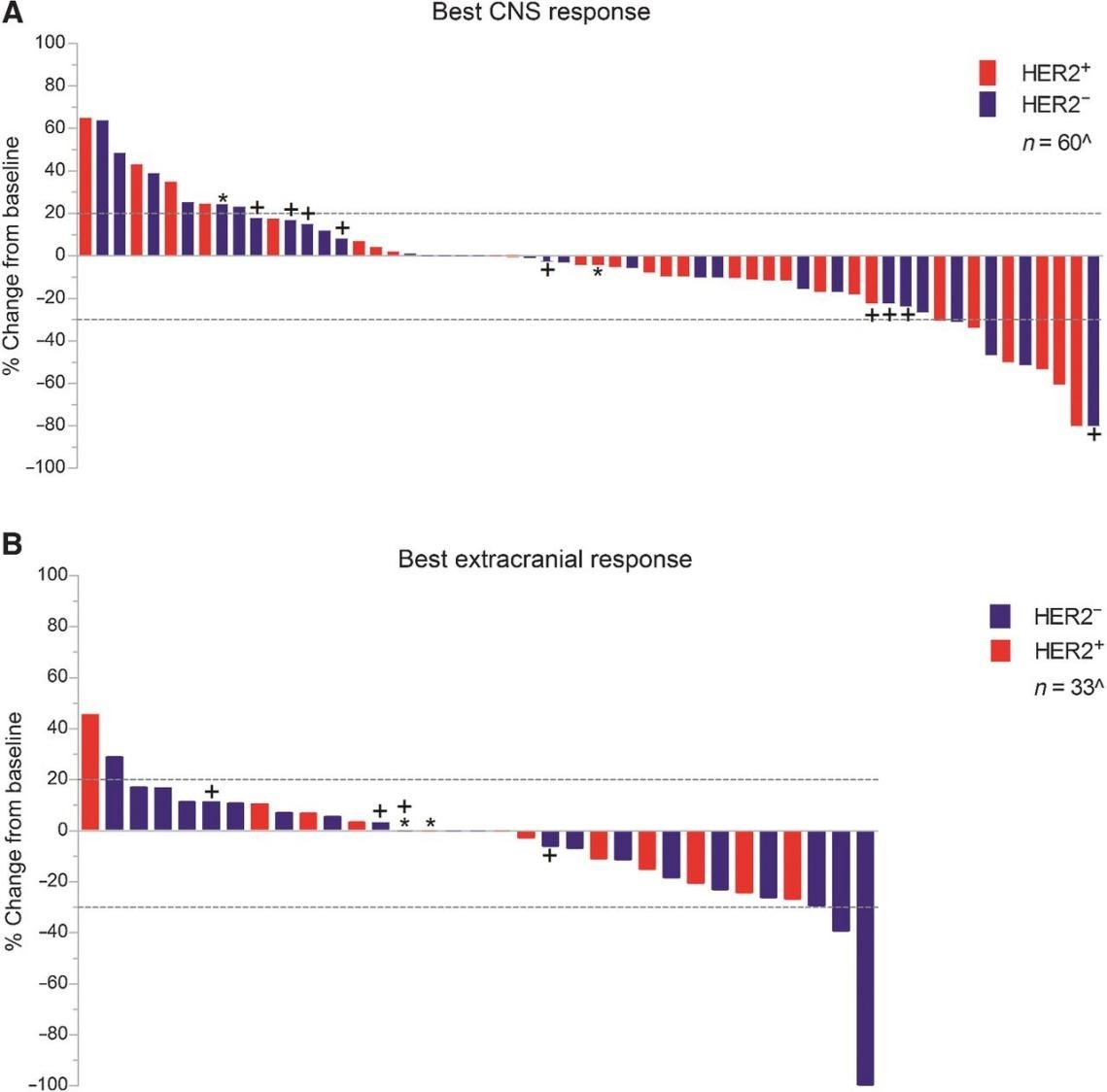
图4 评估接受 ANG1005 治疗的 BCBM 患者的最佳中枢神经系统(A)和颅外(B)反应
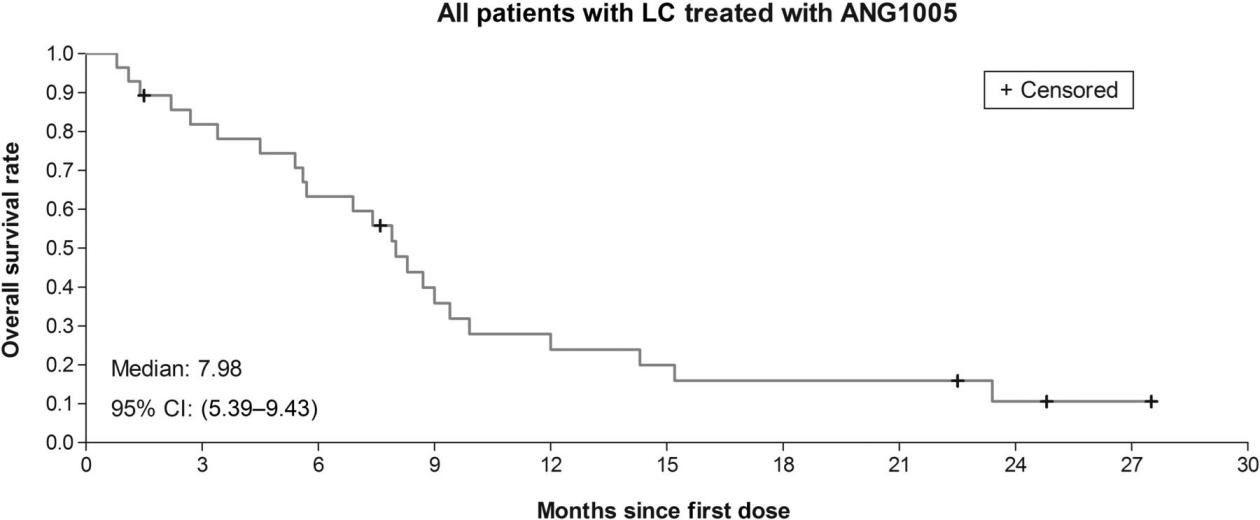
图5 Kaplan-Meier评估ANG1005治疗轻脑膜癌(LC) BCBM (n = 28)患者的生存率
3.2 BT8009 的研究现状
Zelenectide pevedotin(BT8009)是 Bicycle Therapeutics 公司在研的一种靶向Nectin-4的高选择性双环肽(Bicycle®)毒素偶联物(BTC),由靶向Nectin-4的双环肽、可裂解连接子和MMAE毒素偶联而成(见图6)。据Bicylce官网显示,BT8009已经进入临床III期,是全球首个启动III期临床的靶向Nectin-4 PDC。
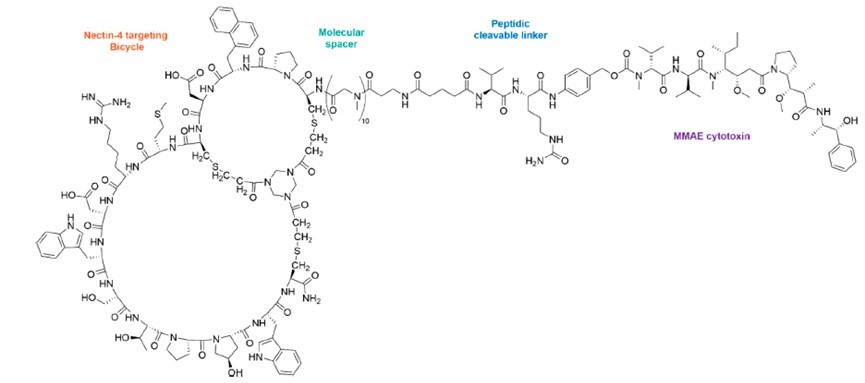 图6 BT8009的结构图
图6 BT8009的结构图
在2023年AACR GU会议,Bicylce公布了BT8009的Ⅰ/Ⅱ期临床数据(Duravelo-1),总计入组49例患者,其中24例为尿路上皮癌(UC)患者,并且UC患者100%接受过PD-(L)1抑制剂治疗。在UC中,ORR为38%,DCR为54%。疗效与唯一上市的靶向Nectin4的ADC药物Enfortumab Vedotin(Padcev)在III期临床研究中展现的ORR(40.6%)和DCR(71.9%)相当,或略逊一筹。但是早期临床和III期临床的样本量不能相提并论,样本量少会导致较大误差。然而在今年ASCO会议上,截至2024年3月22日,BT8009的3级及以上TRAEs发生率为31%;Padcev在III期临床研究中3级及以上TRAEs的发生率则为51.4%,在安全性方面略胜Padcev一筹,这也需要后续大样本临床数据进行验证。
在今年1月24日,Bicycle启动了一项评估BT8009单药和联合Pembrolizumab(Keytruda)在局部晚期或转移性尿路上皮癌患者的临床II/III期试验(NCT06225596/BT8009-230/ Duravelo-2),计划入组956例患者。在12月12日,Bicycle官网公布了BT8009最新的临床数据,BT8009+Keytruda联合一线治疗转移性尿路上皮癌,20例患者可评估疗效,ORR为60%,安全性和耐受性与单药Duravelo-1数据大体一致。而Padcev+Keytruda已经获批一线治疗转移性尿路上皮癌,ORR为67.7%。但是该临床数据最大的亮点在于如果将患者局限到Nectin-4基因扩增或多体型时,BT8009在乳腺癌的ORR为62.5%,三阴乳腺癌的ORR为57.3%,非小细胞肺癌的ORR为40.0%。因此,Bicycle Therapeutics后续将启动BT8009在Nectin-4基因扩增的乳腺癌、非小细胞肺癌的1/2期临床试验。
3.3 BT8009与同靶点上市ADC药物Padcev对比分析
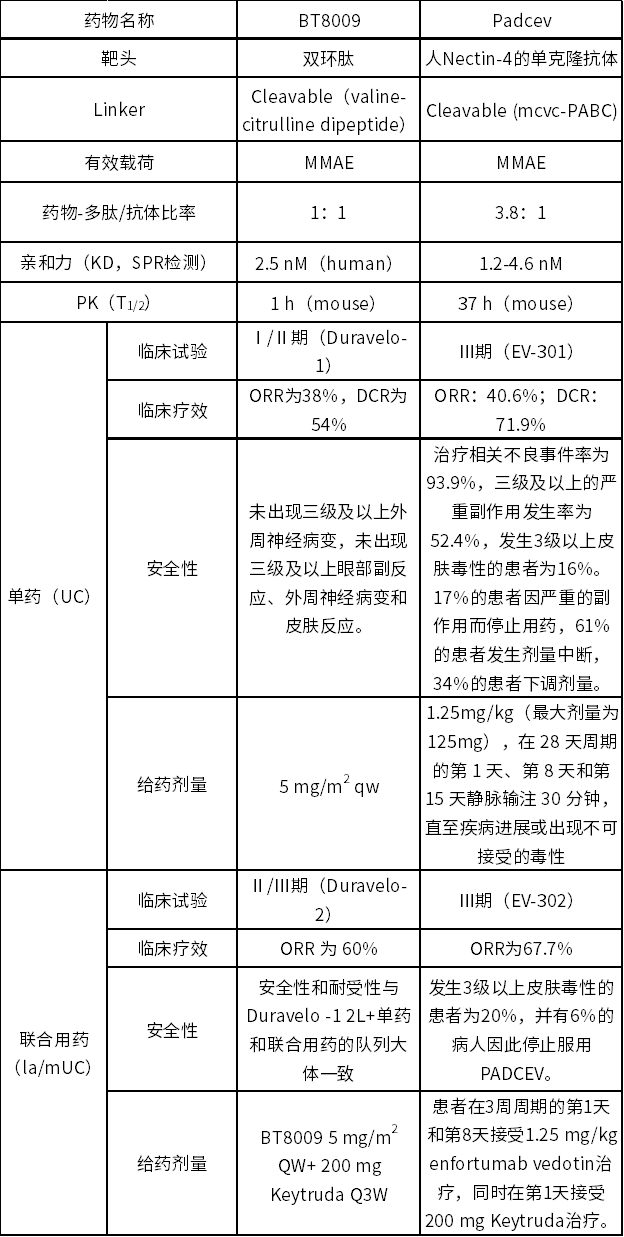
我们将BT8009与Padcev的具体对比结果进行列表汇总(见表3),根据对比信息我们可以发现BT8009与Padcev在结构上最大的区别为靶头类型,连接子都是可裂解的,有效载荷皆是MMAE。与Padcev相比,BT8009的亲和力低,半衰期很短,单药及联合用药的疗效均略逊色,但是安全性方面更好,并没有出现3级以上的皮肤毒性。就这些数据来看,BT8009在安全性上体现了较大的优势,这可能得益于PDC的药代特性。双环肽集抗体、小分子药物及肽类的特性于一身,其肽类的性质则提供了可调控的药物动力学半衰期和肾脏清除途径,系统中暴露的游离毒素更少,对系统的毒性更小。此外BT8009在Nectin-4基因扩增的乳腺癌和非小细胞肺癌中表现出较高的ORR,这相比于Padcev只在尿路上皮癌中有疗效在其它实体瘤中却表现平平而言,或许是一个新的突破点[13-15]。
表3 BT8009与Padcev对比
4、展望
综上所述,PDC依旧是一片蓝海,目前尚未有上市的PDC药物,但PDC凭借着:分子量小、免疫原性低、细胞毒性药物选择面广、治疗窗口扩大、合成工艺简单成本低等不可替代的优势,可以克服ADC的一些局限性,未来有超越ADC的潜力。 未来PDC开发的趋势和研究热点包括以下几个方面:①改进连接子技术:开发出更加稳定、可裂解且具有良好生物相容性的连接子,使PDC能够在特定的生理条件下或在肿瘤微环境中特异性地释放药物,提高药物的疗效和安全性;②PDC与计算机辅助药物设计的结合:通过计算机分析,了解多肽及其受体之间的相互作用、对接方法、及结合亲和力。此外,我们可以为目标蛋白设计新的肽,或者通过计算方法预测目标蛋白或蛋白质中某个肽可能结合的位置;③ 双靶点PDC的设计:如果所使用的多肽能够结合同一抗原的不同位点或同一癌细胞表面的不同过表达受体,则会改善受体聚集,加速偶联药物的快速内吞;④双重载药PDC的设计:使用两种不同作用机制的细胞制剂作为有效载荷的双重载药PDC有望克服使用单一药物时潜在的耐药问题。另外,ADC表现出明显的耐药性,耐药性的机制复杂多样,涉及抗原表达的变化、细胞内化和转运的失败、溶酶体功能受损、药物外排泵的过表达以及旁路信号通路的激活等。如果PDC借助多肽不一样的优势克服这些耐药性,则可能填补ADC的不足,在抗肿瘤治疗中也开创一席之地。总的来说,随着科学技术的不断发展及药物开发者的不断努力,将来PDC药物也将得到更广泛的开发和应用,为人类的持续健康发展做出重要贡献。
参考文献
- 1.Wang M, Liu J, Xia M, Yin L, Zhang L, Liu X, Cheng Y. Peptide-drug conjugates: A new paradigm for targeted cancer therapy. Eur J Med Chem. 2024 Feb 5;265:116119. doi: 10.1016/j.ejmech.2023.116119. Epub 2024 Jan 1. PMID: 38194773.
- 2.Cooper BM, Iegre J, O' Donovan DH, Ölwegård Halvarsson M, Spring DR. Peptides as a platform for targeted therapeutics for cancer: peptide-drug conjugates (PDCs). Chem Soc Rev. 2021 Feb 15;50(3):1480-1494. doi: 10.1039/d0cs00556h. PMID: 33346298.
- 3.Fu Z, Li S, Han S, Shi C, Zhang Y. Antibody drug conjugate: the "biological missile" for targeted cancer therapy. Signal Transduct Target Ther. 2022 Mar 22;7(1):93. doi: 10.1038/s41392-022-00947-7. PMID: 35318309; PMCID: PMC8941077.
- 4.Dean TT, Jelú-Reyes J, Allen AC, Moore TW. Peptide-Drug Conjugates: An Emerging Direction for the Next Generation of Peptide Therapeutics. J Med Chem. 2024 Feb 8;67(3):1641-1661. doi: 10.1021/acs.jmedchem.3c01835. Epub 2024 Jan 26. PMID: 38277480; PMCID: PMC10922862.
- 5.Alas M, Saghaeidehkordi A, Kaur K. Peptide-Drug Conjugates with Different Linkers for Cancer Therapy. J Med Chem. 2021 Jan 14;64(1):216-232. doi: 10.1021/acs.jmedchem.0c01530. Epub 2020 Dec 31. PMID: 33382619; PMCID: PMC8610607.
- 6.Brandsch M, Knütter I, Bosse-Doenecke E. Pharmaceutical and pharmacological importance of peptide transporters. J Pharm Pharmacol. 2008 May;60(5):543-85. doi: 10.1211/jpp.60.5.0002. PMID: 18416933.
- 7.Tsuchikama K, An Z. Antibody-drug conjugates: recent advances in conjugation and linker chemistries. Protein Cell. 2018 Jan;9(1):33-46. doi: 10.1007/s13238-016-0323-0. Epub 2016 Oct 14. PMID: 27743348; PMCID: PMC5777969.
- 8.Gong L, Zhao H, Liu Y, Wu H, Liu C, Chang S, Chen L, Jin M, Wang Q, Gao Z, Huang W. Research advances in peptide‒drug conjugates. Acta Pharm Sin B. 2023 Sep;13(9):3659-3677. doi: 10.1016/j.apsb.2023.02.013. Epub 2023 Feb 28. PMID: 37719380; PMCID: PMC10501876.
- 9.Samantasinghar A, Sunildutt NP, Ahmed F, Soomro AM, Salih ARC, Parihar P, Memon FH, Kim KH, Kang IS, Choi KH. A comprehensive review of key factors affecting the efficacy of antibody drug conjugate. Biomed Pharmacother. 2023 May;161:114408. doi: 10.1016/j.biopha.2023.114408. Epub 2023 Feb 24. PMID: 36841027.
- 10.Gong L, Zhao H, Liu Y, Wu H, Liu C, Chang S, Chen L, Jin M, Wang Q, Gao Z, Huang W. Research advances in peptide‒drug conjugates. Acta Pharm Sin B. 2023 Sep;13(9):3659-3677. doi: 10.1016/j.apsb.2023.02.013. Epub 2023 Feb 28. PMID: 37719380; PMCID: PMC10501876.
- 11.Fu C, Yu L, Miao Y, Liu X, Yu Z, Wei M. Peptide-drug conjugates (PDCs): a novel trend of research and development on targeted therapy, hype or hope? Acta Pharm Sin B. 2023 Feb;13(2):498-516. doi: 10.1016/j.apsb.2022.07.020. Epub 2022 Aug 3. PMID: 36873165; PMCID: PMC9978859.
- 12.Kumthekar P, Tang SC, Brenner AJ, Kesari S, Piccioni DE, Anders C, Carrillo J, Chalasani P, Kabos P, Puhalla S, Tkaczuk K, Garcia AA, Ahluwalia MS, Wefel JS, Lakhani N, Ibrahim N. ANG1005, a Brain-Penetrating Peptide-Drug Conjugate, Shows Activity in Patients with Breast Cancer with Leptomeningeal Carcinomatosis and Recurrent Brain Metastases. Clin Cancer Res. 2020 Jun 15;26(12):2789-2799. doi: 10.1158/1078-0432.CCR-19-3258. Epub 2020 Jan 22. PMID: 31969331.
- 13.Rigby M, Bennett G, Chen L, Mudd GE, Harrison H, Beswick PJ, Van Rietschoten K, Watcham SM, Scott HS, Brown AN, Park PU, Campbell C, Haines E, Lahdenranta J, Skynner MJ, Jeffrey P, Keen N, Lee K. BT8009; A Nectin-4 Targeting Bicycle Toxin Conjugate for Treatment of Solid Tumors. Mol Cancer Ther. 2022 Dec 2;21(12):1747-1756. doi: 10.1158/1535-7163.MCT-21-0875. PMID: 36112771; PMCID: PMC9940631.
- 14.Tong JTW, Harris PWR, Brimble MA, Kavianinia I. An Insight into FDA Approved Antibody-Drug Conjugates for Cancer Therapy. Molecules. 2021 Sep 27;26(19):5847. doi: 10.3390/molecules26195847. PMID: 34641391; PMCID: PMC8510272.
- 15.Challita-Eid PM, Satpayev D, Yang P, An Z, Morrison K, Shostak Y, Raitano A, Nadell R, Liu W, Lortie DR, Capo L, Verlinsky A, Leavitt M, Malik F, Aviña H, Guevara CI, Dinh N, Karki S, Anand BS, Pereira DS, Joseph IB, Doñate F, Morrison K, Stover DR. Enfortumab Vedotin Antibody-Drug Conjugate Targeting Nectin-4 Is a Highly Potent Therapeutic Agent in Multiple Preclinical Cancer Models. Cancer Res. 2016 May 15;76(10):3003-13. doi: 10.1158/0008-5472.CAN-15-1313. Epub 2016 Mar 24. PMID: 27013195.
*声明:本文仅是介绍医药疾病领域研究进展或简述研究概况或分享医药相关讯息,并非也不会进行治疗或诊断方案推荐,也不对相关投资构成任何建议。



