多肽偶联(递送)小核酸技术的前沿探索
发布时间:
2024-12-09
作者:
王斌 博士,中晟全肽研发战略部高级科学家
1、全球主要核酸药物递送系统
核酸药物领域经历了迅速发展,特别是反义寡核苷酸(antisense oligonucleotides,ASOs)、小干扰RNA(small interfering RNA,siRNA)、适配体等寡核苷酸药物以及mRNA疫苗的兴起,引起了业界的广泛关注。与传统药物相比,核酸药物具有高度特异性、高效性和持久性等诸多优点[1]。此外,它们能够靶向那些难以成药的靶点,并可用于转录后基因的沉默或激活治疗[2],因此在生物医学研究领域被视为极具前景的药物开发方向。有望成为继抗体药物之后的第三代生物技术产业浪潮 。相关的给药系统吸引了大量投资,尤其在遗传性罕见病,慢性疾病和肿瘤精准治疗领域,成为最大的生物技术市场之一。然而,寡核苷酸药物的发展并非坦途,其实现在临床上的广泛应用仍面临诸多挑战。例如,寡核苷酸在血液中稳定性差,半衰期短,且主动靶向能力不足;同时,由于其自身带有负电荷,与细胞膜之间存在排斥作用,导致其在细胞内吞作用和逃逸内涵体的能力受限[3]。
为了克服这些限制,提高寡核苷酸的递送效率和临床应用潜力,研究人员探索了将寡核苷酸与其他功能分子进行偶联的方法 ,这种方法旨在改善寡核苷酸细胞摄取、组织传递和生物利用度,进而提升成药性[4]。当前,偶联的功能分子包括N-乙酰半乳糖胺(N-acetylgalactosamine,GalNAc)[5]、亲脂性分子[6]、多肽[4]、小分子药物[7]、抗体[8]等(图1)。通过寡核苷酸药物的偶联技术 ,可以为其提供“导航”功能,促进靶向传递至特定细胞和组织[9],显著降低药物的毒性。

图1. 核酸药物递送系统
核酸药物要发挥疗效,关键在于能够顺利到达并进入病变细胞,这一过程离不开靶向递送系统的支持。目前,研究比较成熟的递送技术主要包括GalNAc和LNP两种。GalNAc为N-乙酰半乳糖胺,通过中间酸敏感的化学linker与小核酸药物相连。这种酸敏感的linker设计巧妙,能确保核酸偶联物在通过内吞体进入细胞后,与linker脱离,从而释放药物。GalNAc可与肝实质细胞表面的糖蛋白受体ASGPR特异性结合,形成的复合物通过胞吞作用进入肝细胞。值得一提的是,ASGPR不仅具有较高的循环速率,能重复使用,还能结合胞外其它GalNAc,最终减少给药剂量[10]。ASGPR仅在肝实质细胞高表达,利用GalNAc递送可精确靶向肝脏,治疗肝部疾病。目前,已上市的三款siRNA药物均采用了GalNAc递送,这使其成为目前应用成熟的小核酸递送方式之一。据统计,全球研发管线中约三分之一的药物基于此技术[5]。疾病领域覆盖遗传性代谢类疾病和心血管系统类疾病。然而,GalNAc的局限性也十分明显,仅能靶向肝脏。因此,发展靶向肝部以外的递送技术,成为第三代小核酸递送技术的关键所在(图1)。这一技术已成为多家制药公司新一代递送系统发展的重要方向[11]。
尽管有许多技术能够将核酸递送到肝细胞,但仍然需要针对其他组织特定细胞表面受体的策略。抗体已经被用作其他类型药物的递送载体,尽管它们在寡核苷酸递送中的应用仍处于早期发展阶段。抗体与细胞表面受体之间的特异性相互作用有潜力使递送能够到达其他技术无法接触的组织和/或细胞亚群。已经成功针对多种受体进行siRNA递送,包括HIV gp160蛋白、HER2[12]、CD7(T细胞标记)[13]、CD71(在心脏和骨骼肌中高度表达的转铁蛋白受体)[14]以及TMEFF2[15]。类似地,ASO(反义寡核苷酸)也与针对CD44(神经干细胞标记)、EPHA2和EGFR[16]的抗体结合。在这些情况下,ASO作为与DNA载体链的双链形式递送,抗体通过点击化学与DNA载体链连接。这种设计允许DNA载体在细胞进入后被降解,从而释放ASO。针对骨骼肌等组织的抗体–siRNA和抗体–ASO共轭物目前正在Avidity Biosciences和Dyne Therapeutics开发中。
2、多肽的特殊优势
多肽以其小分子量、低免疫原性、高特异性和肾脏排泄等特点,巧妙地融合了大分子和小分子的优势。多肽的靶向功能在多种应用场景中均展现出显著作用。相较于目前的抗体,经过精心改造与环化的多肽,其亲和力已达到纳摩尔级水平,而且内吞效率并不单纯依赖亲和力,内吞后的多肽同样需要解离。相比抗体,多肽天然具备诸多优势,诸如小分子量和可以通过非天然氨基酸改造来显著延长半衰期,多肽分子量与抗体相差悬殊,近150倍,这直接导致注射剂量的巨大差异。这一特性在杂质控制和降低副作用方面展现出明显的优势(图2)。那么,多肽与小核酸偶联形成的多肽偶联物(POC)将会产生哪些的颠覆性创新呢?
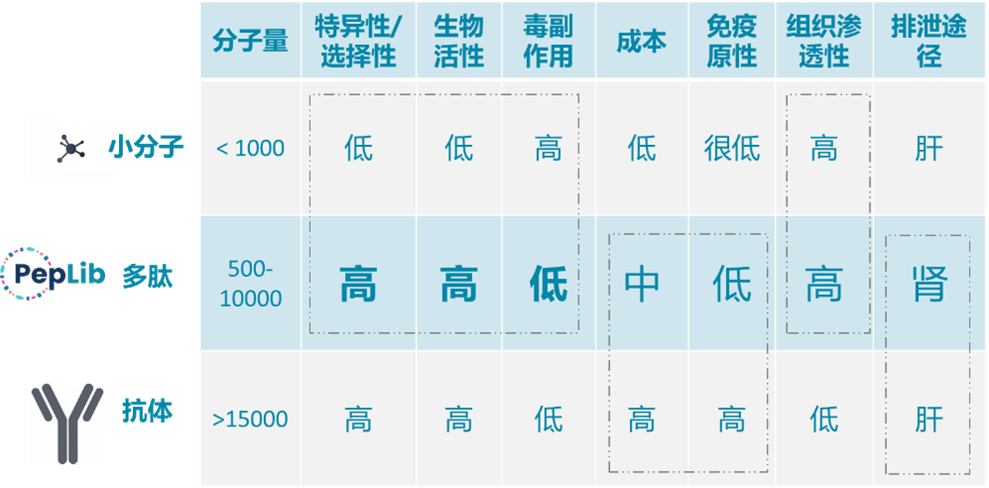
图2 多肽作为小核酸递送的特点(PepLib官网)
3、全球多肽偶联小核酸物研究现状
穿膜肽(Cell-Penetrating Peptide, CPP)与寡核苷酸的偶联物,作为当前领域的研究领域的热点,正受到广泛关注。CPP由5到40个氨基酸残基组成,通常为阳离子或两亲性的多肽片段。其核心优势是能够穿过细胞膜,高效促进细胞内各种有效载荷的运输,进而有效地将小核酸递送至目标部位[4]。目前,Entrada、PepGen和Sarepta等专注于小核酸递送领域具有深厚底蕴的研发公司正积极推动这项技术,应用于将siRNA和磷酰二胺吗啉代寡核苷酸(PMO)递送到肌肉组织,例如如增强递送寡核苷酸(enhanced delivery oligonucleotide,EDO)(PepGen)和SRP-5051(Sarepta)。
另一类被称为细胞靶向性肽(CTPs)的多肽是通过噬菌体或RNA展示技术开发的,这些多肽能够特异性与某些组织上高度表达的受体(如转铁蛋白1)结合。通过这些受体的高效内吞和溶酶体逃逸机制,CTP能够实现对特定器官的靶向递送。目前,CTPs已成功应用于将反义寡核苷酸(ASOs)递送至心脏组织,以及将siRNA和DNA质粒递送到脊髓或小胶质细胞中[17]。该技术主要由头部的小核酸开发公司如Ionis和Alnylam与专门环肽筛选开发平台公司合作开发环肽/siRNA/ASO偶联药物(表1)。
表1. 全球多肽偶联小核酸物研究情况

3.1 lonis多肽偶联物平台
Ionis在多肽偶联核酸(POC)领域的堪称独树一帜,其与Bicycle双方携手构建了ASO/多肽平台,目前批露的信息聚焦于转铁蛋白受体1(TfR1)的应用。
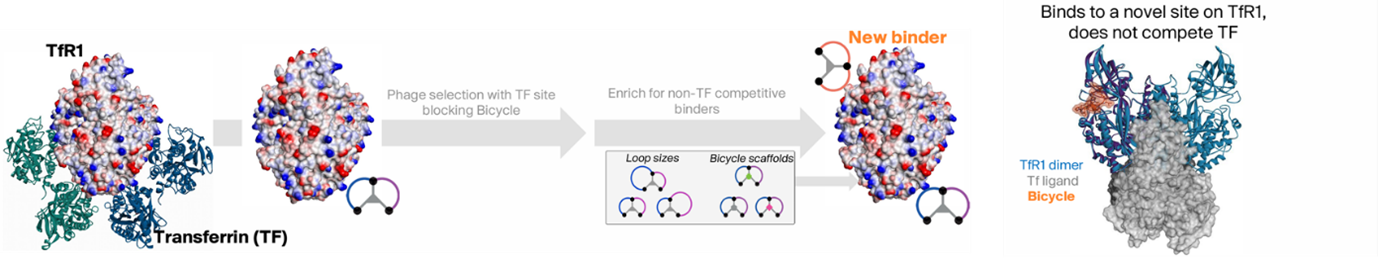
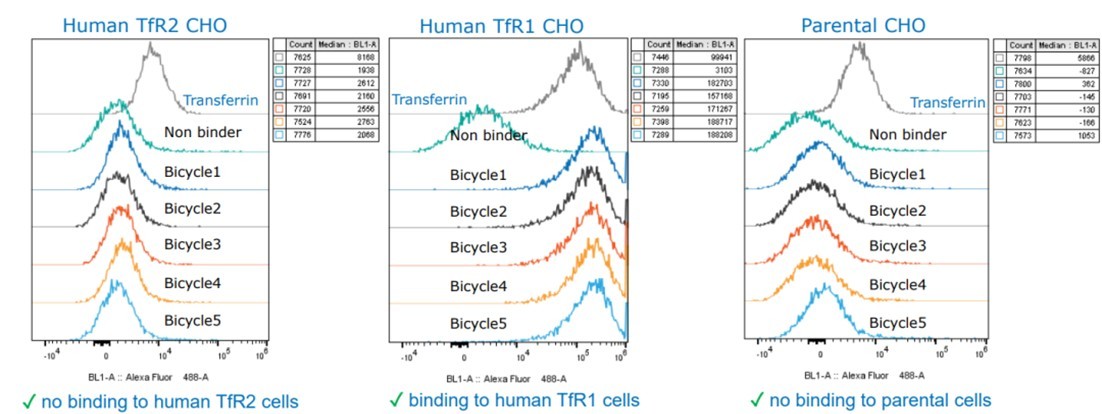
图3 双环肽特异性结合TfR1[18]
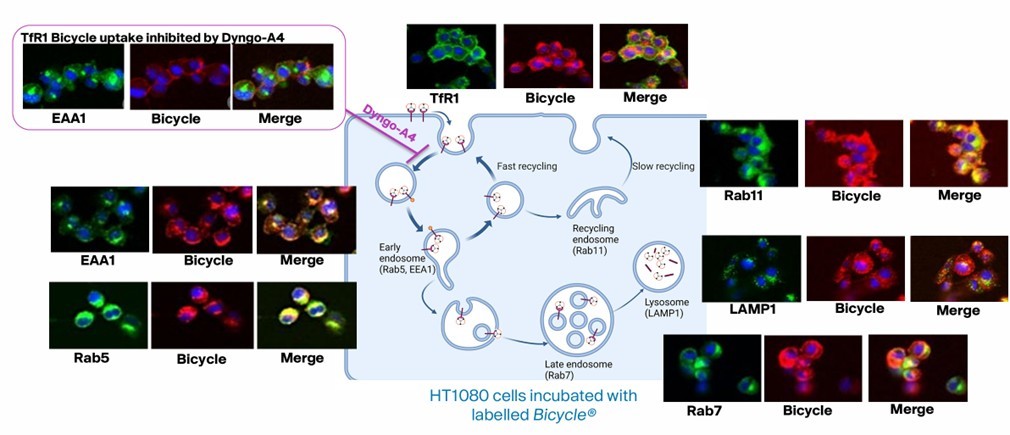
图4 双环肽结合TfR1并介导内吞作用与内体标记物的共定位[18]
经过筛选的双环肽表现出高特异性,它仅特异性地靶向TfR1受体,而与TfR2受体则无结合活性。此外,该双环肽还具备高效的内吞能力,能够经由内体-溶酶体途径进入细胞内部(图4)。此外,这种双环肽还具有一个非常显著的优势,即它不占用转铁蛋白的结合位点,因此不会干扰转铁蛋白对铁离子的转运(图3)。当与ASO偶联后,该环肽依然能够保持与TfR1高亲和力结合,从而有效地介导siRNA在hTfR1KI/+小鼠中的递送(图5)。TfR1受体在BBB上和肌肉细胞表面呈现出高度的特异性表达,因此可以作为靶向肝脏以外组织的关键受体,这一特性使得适应症范围得到进一步拓展,预示着它在多种神经系统疾病和罕见病的资料领域具有巨大的潜力价值。
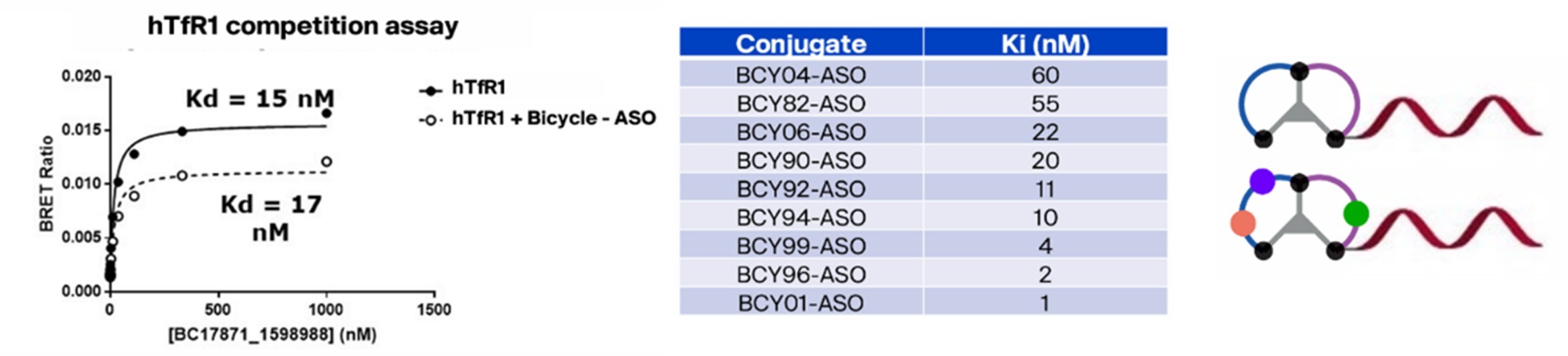
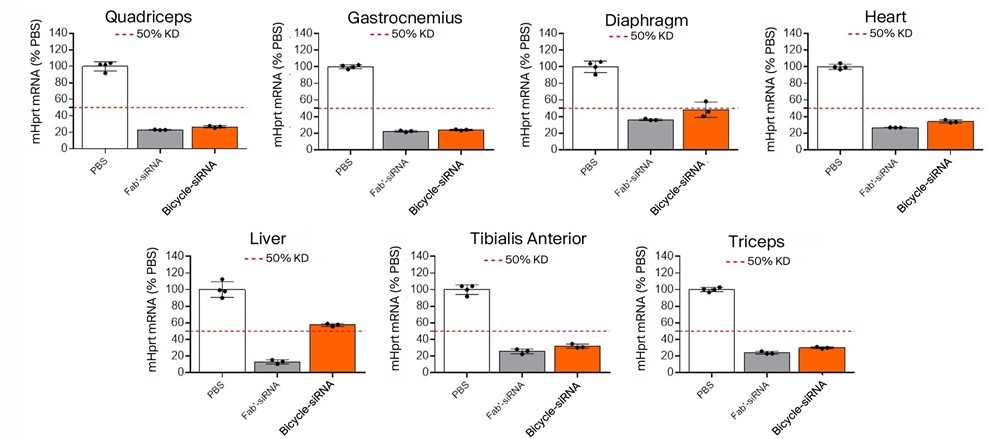
图5 双环肽偶联ASO与TfR1高亲和力结合有效介导siRNA在hTfR1KI/+小鼠中的递送[18]
Ionis Pharmaceuticals已批露的还在开发的一个为靶向低密度脂蛋白受体(LDLR)的多肽偶联递送平台。Ionis获得 Vect-Horus 独有的VECTrans 靶向技术平台的全球排他性许可,该许可涵盖特定数量的靶点,旨在推动系统给药型RNA靶向疗法的革新与发展。最新发布的研究报告揭示,通过运用表达小鼠和人类低密度脂蛋白受体(LDLR)的先进工程化细胞系,成功实施了噬菌体展示肽库的高通量筛选。随后,对筛选出的环肽进行深度化学优化,力求达到 LDLR 结合的极致亲和力和卓越的血浆稳定性,进而大幅提升 SOD1 干扰药物的递送效率(图6)[19]。借助这一创新技术开发的疗法,有望突破血脑屏障的制约,精准靶向中枢神经系统中的特定靶点。
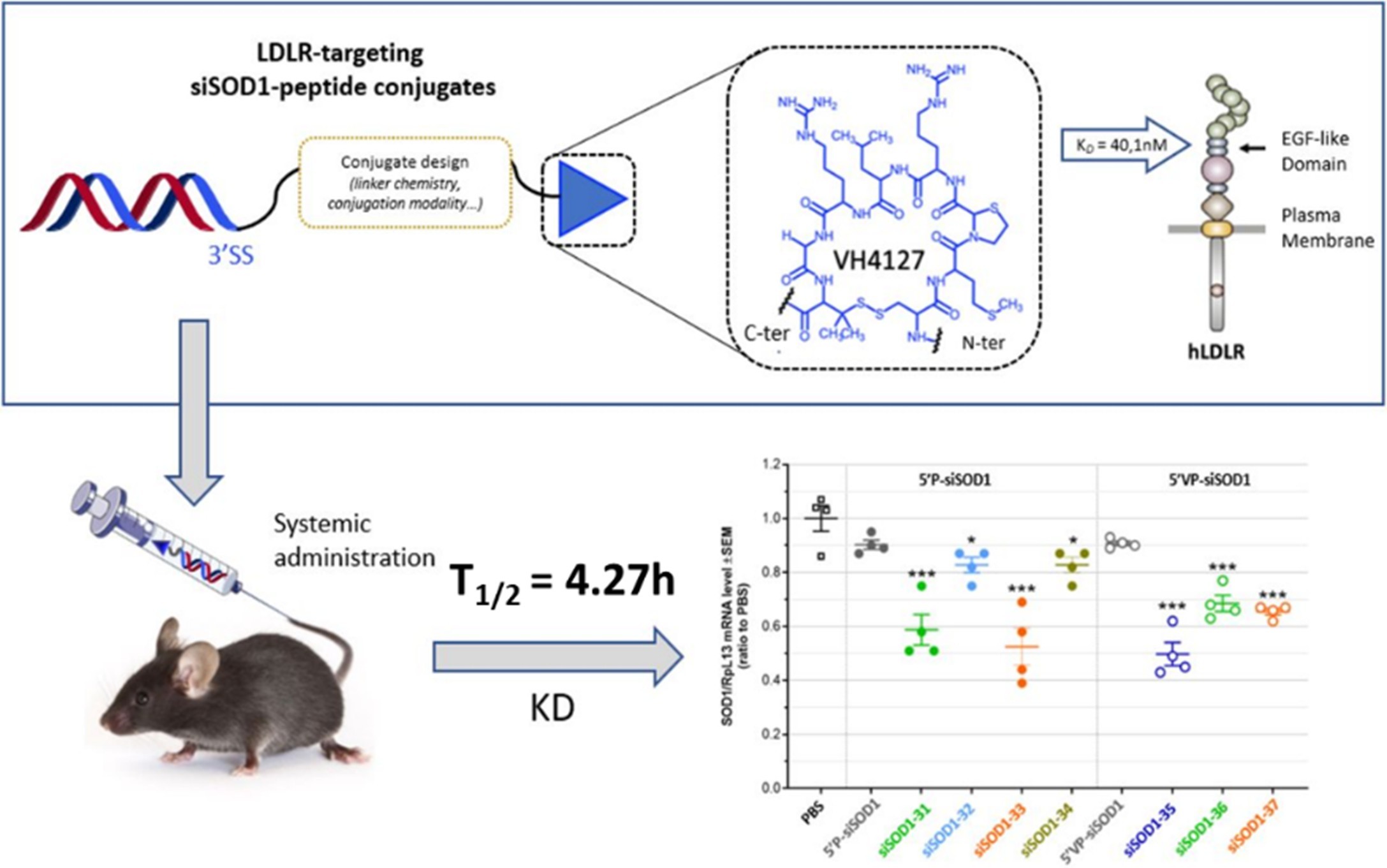
图6 开发靶向低密度脂蛋白受体(LDLR)的肽偶联SOD1的小干扰RNA(siRNA)分子[19]
3.2 Alnylam多肽偶联物平台
Alnylam在全球siRNA领域处于领先地位,其技术起点是专注于肝脏靶向的GalNAc递送系统。随着技术的不断革新与迭代,Alnylam逐渐扩展至多肽核酸递送系统(图7)。2021年7月30日,Alnylam与PeptiDream携手达成了一项价值高达22亿美元的合作协议,共同致力于多肽-siRNA偶联药物的研发。双方将共同努力,通过创新的递送系统,将药物递送至中枢神经系统(靶向LRP-1)、肌肉组织、肺部(利用LNP脂质体多肽嵌合技术)以及心脏等关键部位,从而开辟全新的治疗途径(图8)。
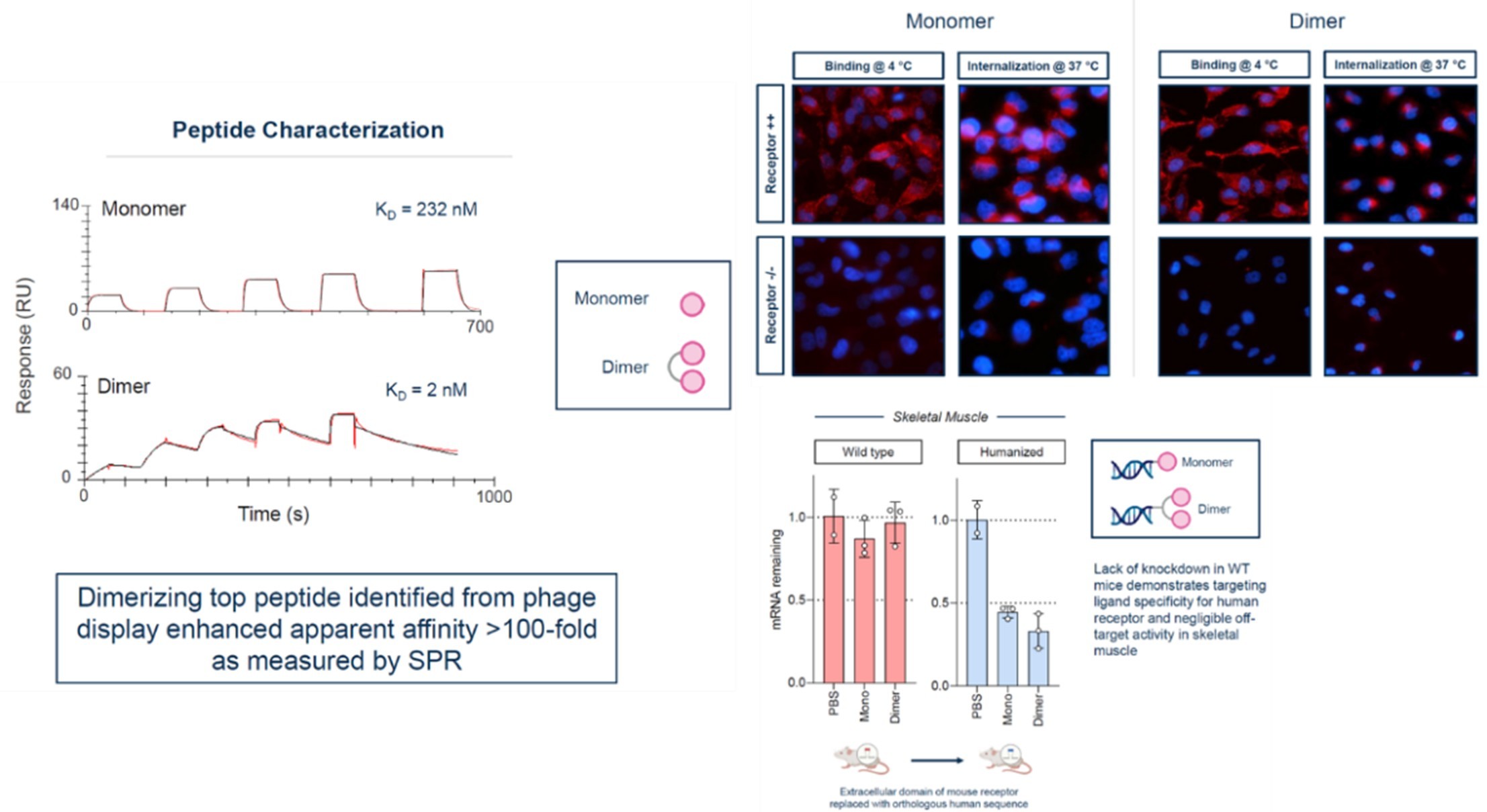

图7 Alnylam 肌肉靶向肽偶联物在小鼠骨骼肌和心脏肌肉中实现持久的基因沉默[20]
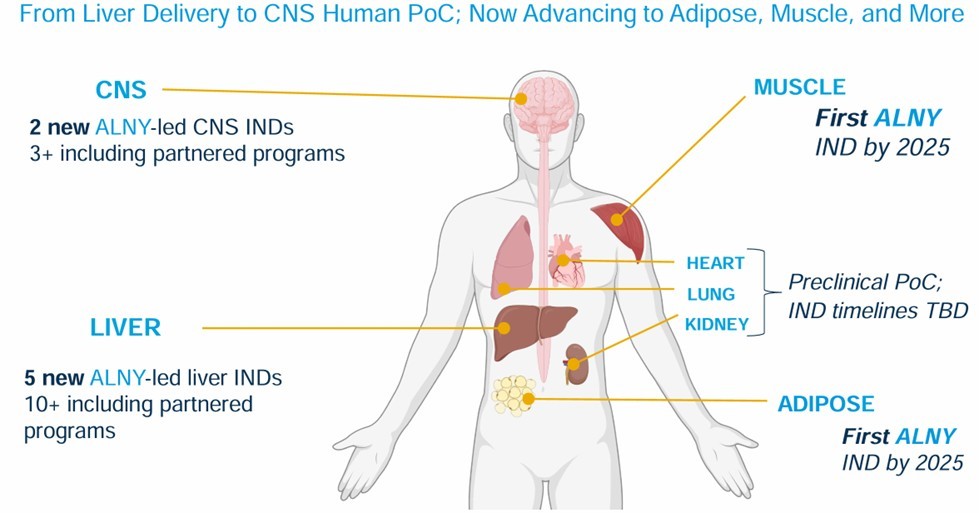
图8 Alnylam 小核酸递送的更新迭代-肝外小核酸递送的临床计划[20]
3.3 Entrada Therapeutics多肽偶联物平台
Entrada Therapeutics内体逃逸载体(EEV™)平台,通过偶联大环肽和细胞穿透肽(CPP),实现了的多肽偶联物的高摄取率(达90%)和近50%内涵体逃逸率。相比之下,未偶联的核酸摄取极低,且内涵体逃逸率不足2% (图9)。Entrada公司的多肽递送系统具备以下显著特点及优势:1、环肽结构显著延长了多肽的半衰期,并增强了其稳定性。2、CPP具有透过磷脂双分子层的独特能力,因此能够广泛作用于各种细胞类型。3、独特的化学结构设计进一步优化了药物的摄取效率和内涵体逃逸能力(图10)。除此以外,加入NLS(细胞核定位信号肽),进一步增强PMO入核效率,提升成药性。
ENTR-601-44是Entrada公司基于创新的内体逃逸载体平台(EEV)和 PMO结合而开发的专有产品,目前处于健康志愿者参与的1期临床试验。临床前数据表明其内体逃逸率达到了 50%。相较传统生物疗法的内体逃逸率仅为1-2%。然而,ENTR-601-44在美国的监管审批之路却遭遇了挫折。2022年12月19日,Entrada Therapeutics宣布,其旗下进展最快的Peptide-ASO产品候选药物ENTR-601-44的IND申请被FDA叫停。叫停的原因还有待更进一步数据公布,分析可能是由于其宣称的内体逃逸率达到了50%的高精氨酸细胞渗透肽毒性太大导致。
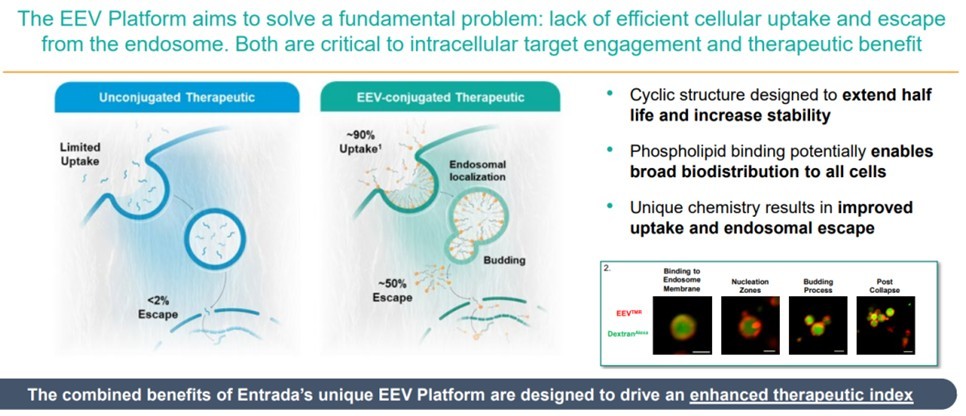
图9 Entrada 内体逃逸载体(EEVTM)平台[21]

图10 Entrada 多肽相关结构[21]
3.4 PepGen Therapeutics多肽偶联物平台
PepGen是一家专注于细胞穿透肽CPPs领域研发的公司,其倾力打造的EDO™肽-寡核苷酸偶联递送平台,通过优化结构,显著提升了溶酶体逃逸效率,进而增强了药物的成药性。EDO肽在结构上的设计独树一帜,与其他递送肽存在显著差异。值得注意的是,在针对野生型小鼠单剂量实验中,EDO肽不仅展示出相当的活性,还在肾脏安全性方面表现出显著改善(图11)。
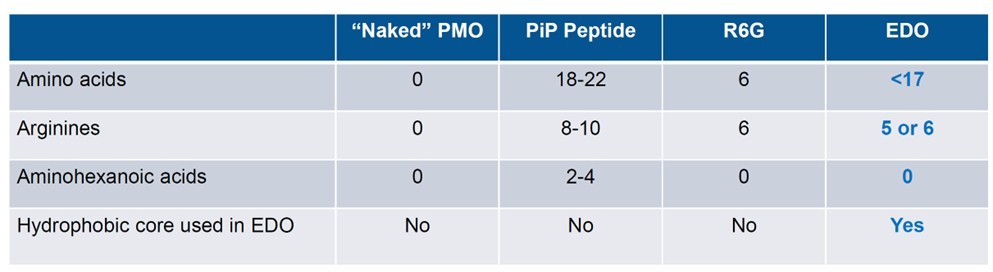
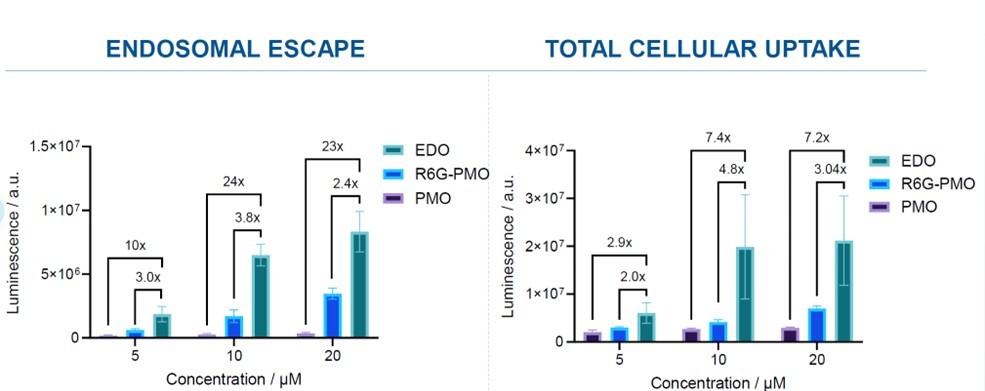

图11 EDO 肽偶联物的尿液安全性指标显著低于其他肽偶联物[22]
PGN-EDO51是PepGen重点研发的一款多肽-寡核苷酸偶联药物,目前正处于临床二期研究阶段。其中核心组成部分EDO肽,凭借其卓越的递送能力,实现了对寡核苷酸的有效运输。这些寡核苷酸通过精准跳跃外显子51,生成了一种功能更为紧凑的抗萎缩蛋白,从而为治疗杜氏肌营养不良症(DMD)患者带来了新的治疗希望。在众多获批或正在研发中的DMD治疗药物中,PGN-EDO51凭借其卓越的外显子跳跃效率,能够生成更高水平的抗肌萎缩蛋白,展现出非凡的治疗潜力。此外,市场投资机构对GN-EDO51的未来销售前景持乐观态度,如SVB分析师预测,GN-EDO51全球销售额峰值有望在2035年达到7.3亿美元。
3.5 Arrowhead Therapeutics多肽偶联物平台
Arrowhead公司利用其自主研发的靶向RNAi分子(TRiM™) 平台,专注于开发针对肺部疾病的RNA干扰治疗药物,该平台的研发重点包括黏液阻塞和炎症性肺部疾病。值得注意的是,Arrowhead的多个管线均聚焦于肺部,且均以avβ6(尽管具体分子尚未公开,据推测应是基于RDG序列的多肽)为靶点,目前,这些项目均已进入临床I/II期研究阶段(图12)。此外,Arrowhead还在对另一款针对avβ6的候选药物ARO-DUX4进行临床I/II期研究。
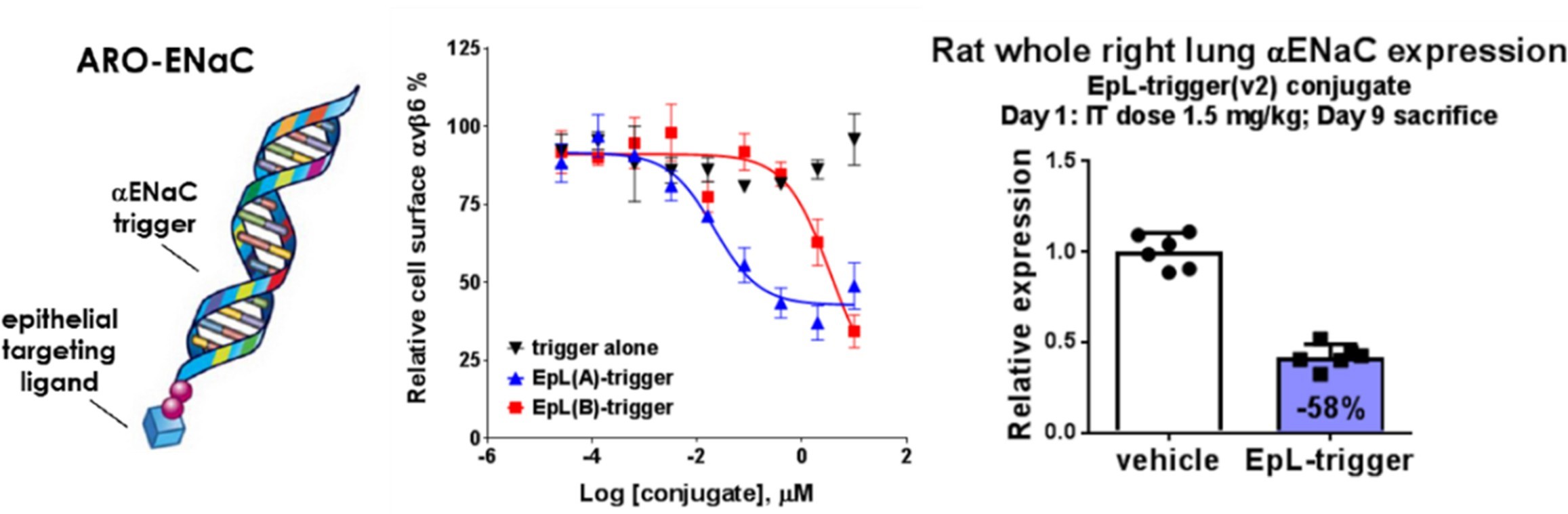
图12 Arrowhead基于avβ6的多肽偶联药物靶向肺部并有效沉默肺部靶点蛋白[23]
4、总结
尽管现有多种核酸药物递送技术,但在特定组织的靶向递送上仍存在挑战。多肽作为一种创新的靶向递药系统,凭借其独特的结构和性质,成功克服了许多递送系统的障碍。多肽与小核酸的结合可显著提高细胞摄取效率和内涵体逃逸能力,从而增强疗效。通过化学修饰,非天然氨基酸可延长多肽药物的半衰期,提升其在体内的有效作用时间。此外,环肽技术的进步增强了多肽的稳定性和与靶蛋白的亲和力。多肽-药物偶联物(PDC)展现出强大的肿瘤穿透能力、无免疫原性和良好的肾代谢特性,随着相关技术的发展,其临床应用潜力将不断被挖掘,给患者带来更多希望。
参考文献
- 1.Capaldi, D.; Teasdale, A.; Henry, S.; Akhtar, N.; Den Besten, C.; Gao-Sheridan, S.; Kretschmer, M.; Sharpe, N.; Andrews, B.; Burm, B.; Foy, J. Impurities in Oligonucleotide Drug Substances and Drug Products. Nucleic Acid Therapeutics 2017, 27 (6), 309–322. https://doi.org/10.1089/nat.2017.0691.
- 2.Wu, S. Y.; Lopez-Berestein, G.; Calin, G. A.; Sood, A. K. RNAi Therapies: Drugging the Undruggable. Sci. Transl. Med. 2014, 6 (240). https://doi.org/10.1126/scitranslmed.3008362.
- 3.Craig, K.; Abrams, M.; Amiji, M. Recent Preclinical and Clinical Advances in Oligonucleotide Conjugates. Expert Opinion on Drug Delivery 2018, 15 (6), 629–640. https://doi.org/10.1080/17425247.2018.1473375.
- 4.Klabenkova, K.; Fokina, A.; Stetsenko, D. Chemistry of Peptide-Oligonucleotide Conjugates: A Review. Molecules 2021, 26 (17), 5420. https://doi.org/10.3390/molecules26175420.
- 5.Debacker, A. J.; Voutila, J.; Catley, M.; Blakey, D.; Habib, N. Delivery of Oligonucleotides to the Liver with GalNAc: From Research to Registered Therapeutic Drug. Molecular Therapy 2020, 28 (8), 1759–1771. https://doi.org/10.1016/j.ymthe.2020.06.015.
- 6.Tran, P.; Weldemichael, T.; Liu, Z.; Li, H. Delivery of Oligonucleotides: Efficiency with Lipid Conjugation and Clinical Outcome. Pharmaceutics 2022, 14 (2), 342. https://doi.org/10.3390/pharmaceutics14020342.
- 7.He, J.; Duan, Q.; Ran, C.; Fu, T.; Liu, Y.; Tan, W. Recent Progress of Aptamer‒drug Conjugates in Cancer Therapy. Acta Pharmaceutica Sinica B 2023, 13 (4), 1358–1370. https://doi.org/10.1016/j.apsb.2023.01.017.
- 8.Dugal-Tessier, J.; Thirumalairajan, S.; Jain, N. Antibody-Oligonucleotide Conjugates: A Twist to Antibody-Drug Conjugates. JCM 2021, 10 (4), 838. https://doi.org/10.3390/jcm10040838.
- 9.Mullard, A. Antibody–Oligonucleotide Conjugates Enter the Clinic. Nat Rev Drug Discov 2022, 21 (1), 6–8. https://doi.org/10.1038/d41573-021-00213-5.
- 10.Geary, R. S.; Norris, D.; Yu, R.; Bennett, C. F. Pharmacokinetics, Biodistribution and Cell Uptake of Antisense Oligonucleotides. Advanced Drug Delivery Reviews 2015, 87, 46–51. https://doi.org/10.1016/j.addr.2015.01.008.
- 11.马健, 余同林, 崔帅帅, 何裕建, 吴丽. 寡核苷酸偶联物的研究进展[J]. 药学进展, 2024, 48(8): 565-578. DOI: 10.20053/j.Issn1001-5094.2024.08.002.
- 12.Yao, Y.; Sun, T.; Huang, S.; Dou, S.; Lin, L.; Chen, J.; Ruan, J.; Mao, C.; Yu, F.; Zeng, M.; Zang, J.; Liu, Q.; Su, F.; Zhang, P.; Lieberman, J.; Wang, J.; Song, E. Targeted Delivery of PLK1-siRNA by ScFv Suppresses Her2+ Breast Cancer Growth and Metastasis. Sci. Transl. Med. 2012, 4 (130).https://doi.org/10.1126/scitranslmed.3003601.
- 13. Kumar, P.; Ban, H.-S.; Kim, S.-S.; Wu, H.; Pearson, T.; Greiner, D. L.; Laouar, A.; Yao, J.; Haridas, V.; Habiro, K.; Yang, Y.-G.; Jeong, J.-H.; Lee, K.-Y.; Kim, Y.-H.; Kim, S. W.; Peipp, M.; Fey, G. H.; Manjunath, N.; Shultz, L. D.; Lee, S.-K.; Shankar, P. T Cell-Specific siRNA Delivery Suppresses HIV-1 Infection in Humanized Mice. Cell 2008, 134 (4), 577–586. https://doi.org/10.1016/j.cell.2008.06.034.
- 14.Sugo, T.; Terada, M.; Oikawa, T.; Miyata, K.; Nishimura, S.; Kenjo, E.; Ogasawara-Shimizu, M.; Makita, Y.; Imaichi, S.; Murata, S.; Otake, K.; Kikuchi, K.; Teratani, M.; Masuda, Y.; Kamei, T.; Takagahara, S.; Ikeda, S.; Ohtaki, T.; Matsumoto, H. Development of Antibody-siRNA Conjugate Targeted to Cardiac and Skeletal Muscles. Journal of Controlled Release 2016, 237, 1–13. https://doi.org/10.1016/j.jconrel.2016.06.036.
- 15.Cuellar, T. L.; Barnes, D.; Nelson, C.; Tanguay, J.; Yu, S.-F.; Wen, X.; Scales, S. J.; Gesch, J.; Davis, D.; van Brabant Smith, A.; Leake, D.; Vandlen, R.; Siebel, C. W. Systematic Evaluation of Antibody-Mediated siRNA Delivery Using an Industrial Platform of THIOMAB–siRNA Conjugates. Nucleic Acids Research 2015, 43 (2), 1189–1203. https://doi.org/10.1093/nar/gku1362.
- 16.Arnold, A. E.; Malek-Adamian, E.; Le, P. U.; Meng, A.; Martínez-Montero, S.; Petrecca, K.; Damha, M. J.; Shoichet, M. S. Antibody-Antisense Oligonucleotide Conjugate Downregulates a Key Gene in Glioblastoma Stem Cells. Molecular Therapy - Nucleic Acids 2018, 11, 518–527. https://doi.org/10.1016/j.omtn.2018.04.004.
- 17.Terashima, T.; Ogawa, N.; Nakae, Y.; Sato, T.; Katagi, M.; Okano, J.; Maegawa, H.; Kojima, H. Gene Therapy for Neuropathic Pain through siRNA-IRF5 Gene Delivery with Homing Peptides to Microglia. Molecular Therapy - Nucleic Acids 2018, 11, 203–215. https://doi.org/10.1016/j.omtn.2018.02.007.
- 18.Inma Rioja,. Bicyclic Peptides (Bicycles) as Novel Multipurpose Delivery Systems; The BNA 2023 International Festival of Neuroscience.
- 19.B., B. LDLR-Mediated Targeting and Productive Uptake of siRNA-Peptide Ligand Conjugates in Vitro and in Vivo. February 3, 2023. https://doi.org/10.1101/2023.02.03.526778.
- 20.Alnylam R&D Day 2023.
- 21.Leo Qian. The Endosomal Escape Vehicle Platform Safely and Effectively Delivers Oligonucleotide Therapeutics to Skeletal and Cardiac Muscle Tissue for the Potential Treatment of Duchenne Muscular Dystrophy; TIDES EUROPE, November 14, 2024.
- 22.James McArthur. Advancing the Use of Peptide-Conjugated Oligonucleotides to Target Neuromuscular Disorders: Enhanced Delivery Oligonucleotides for DMD and DM1; PepGen September 25, 2024.
- 23.Erik W. Bush. Targeting a ENaC with an Epithelial RNAi Trigger Delivery Platform for the Treatment of Cystic Fibrosis; 1 Arrowhead Pharmaceuticals Inc, 2018.
- 其他来源:各个公司官方网站
*声明:本文仅是介绍医药疾病领域研究进展或简述研究概况或分享医药相关讯息,并非也不会进行治疗或诊断方案推荐,也不对相关投资构成任何建议。



