多肽药物开发领域冉冉升起的新星—Knottin
发布时间:
2024-08-28
作者:
李福燕,中晟全肽研发战略部研究员
引言
多肽药物具有生物活性高、靶向性好、免疫原性较低、安全性较高、药用剂量小、产业化开发优势明显等诸多优点,已成为全球关注的创新药物研发热点之一。但是其代谢不稳定、较难通透组织屏障以及需要通过皮下或静脉注射给药,在实际治疗中的便利性和依从性较低等缺点,严重阻碍了多肽新药在临床治疗中的广泛应用。科学家们探索发现的以超强的稳定性著称的Knottin,或许可以解决这些限制多肽药物的瓶颈。
Knottin是一个具有多种功能的超稳定肽结构家族,长度通常为 30-50 个氨基酸,通过三个以特殊排列方式连接的二硫键形成环,与普通环肽相比,这一紧致的构象使其更加耐受酶切,酸碱和高温,并且这种超强的稳定性使得口服给药成为可能,这是优于多肽药物的主要临床优势。同时,Knottin还被认为是非免疫原性的,因为它们不太容易被蛋白酶水解并呈递给免疫系统。此外,Knottin较小的分子尺寸允许它们通过细胞膜结合细胞内的靶点,具备开发出进入细胞内或穿过血脑屏障的多肽药物的能力[1,2]。基于这些理想的药理特性,如图一所示,经过药化修饰的Knottin被广泛应用于药物开发和实验室研究领域,尤其用于镇痛药物、口服药物和透过血脑屏障药物的研究。
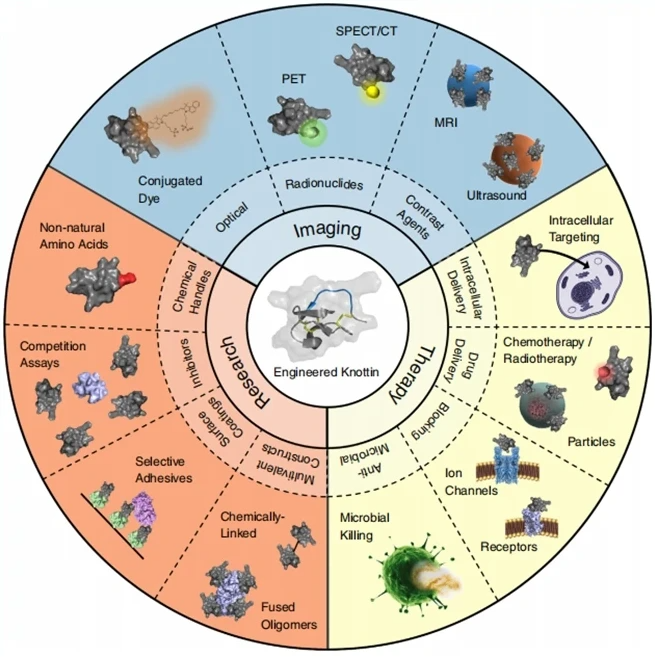
图一 Knottin在成像、治疗和研究中的应用
1、Knottin的结构与生物活性
在典型的Knottin基序中,有一个共同的折叠,其中一个二硫键(位于半胱氨酸3和半胱氨酸6之间)穿过由另外两个二硫键(分别位于半胱氨酸1和半胱氨酸4之间,半胱氨酸2和半胱氨酸5之间)和肽骨架形成的大环,产生一个刚性的分子 "结",形成一个非常稳定的支架(图二)。有研究发现,将Knottin长期暴露于高温、蛋白水解酶和强酸强碱中后,仍能保持其功能和结构的完整性[3];还有研究证明Knottin在生理条件下也可保持稳定,其在胃蛋白酶和弹性蛋白酶作用下不会或仅会出现轻微降解[4]。除了这一稳定区域外,Knottin还具有长度和组成可变的环区,这些环区被限制在反向平行的 β 链的核心上,这些环区对折叠、结构完整性、分子识别和生物功能非常重要[5]。也正是因为这些可变环区允许在连接环的长度和顺序上具有很大的灵活性,使得Knottin具备成为多肽药物筛选骨架的能力。目前可以通过Knottin数据库(http://Knottin.cbs.cnrs.fr/)和Cybase数据库(http://www.cybase.org.au/)查到现有Knottin的全面数据,包括序列、结构、分类和功能的信息。
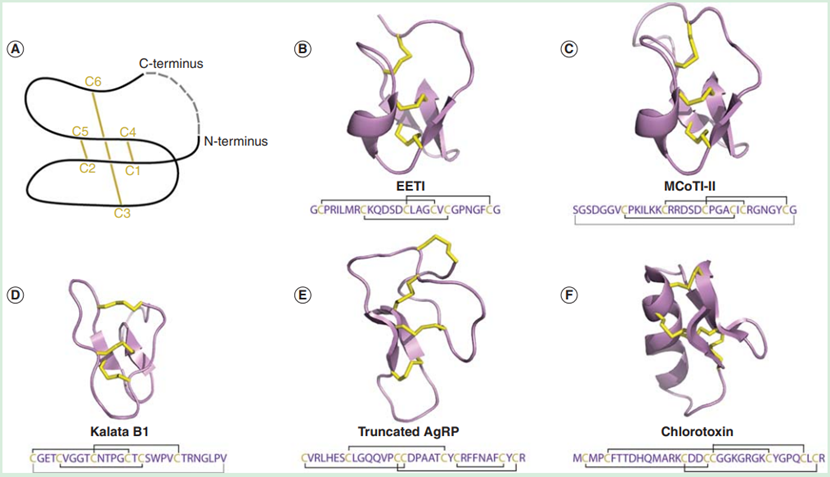
图二 Knottin的结构特征及自然界存在的Knottin的结构和序列
Knottin广泛分布于自然界,例如真菌、植物、昆虫、软体动物、哺乳动物和病毒中。Knottin的家族成员具有广泛的天然生物活性,包括抗菌和抗病毒活性以及选择性阻断或激活离子通道、细胞表面受体和细胞外蛋白酶等,例如,蝎子、蜘蛛和蜗牛的毒素能阻断离子通道活性[6];植物中的Ecballium elaterium trypsin inhibitor II(EETI-II)能通过抑制丝氨酸蛋白酶阻止蛋白质或淀粉的消化来防御害虫[7];而源于人类的Knottin是Agoutisignaling protein(ASIP)和Agouti-related protein(AGRP),含有胱氨酸结折叠的羧基末端结构域,它们作为反向激动剂,分别控制色素沉着和新陈代谢功能,AGRP 是黑皮质素-3 和黑皮质素-4G-蛋白偶联受体的内源性拮抗剂[8]。近年来,随着蛋白质设计和定向进化技术的应用,Knottin的天然生物活性范围进一步扩大。目前已开发出可抑制血小板聚集、阻断哮喘相关蛋白酶、作为生长因子模拟物或针对人类肿瘤靶点的Knottin类药物。
2、Knottin的发现和药用尝试
早在1982年,knottin折叠首次在马铃薯 PCI 的羧肽酶 A 抑制剂中被提出[9]。但直到九十年代初,人们才在葫芦科植物,南瓜胰蛋白酶抑制剂中发现了类似的折叠[10,11],从而提出了一种名为 "knottin "折叠的一般半胱氨酸排列方式[12]。后来,其他一些富含二硫化物的小蛋白家族也显示出 "knottin "折叠,其中最多的家族是蜘蛛和芋螺毒素、茜草科和堇菜科的环肽、哺乳动物的agouti-related and agouti-signaling蛋白以及豌豆毒素[13]。截至目前,在Knottin的数据库中共有3320个Knottin的晶体结构,共分为35个家族,其中芋螺毒素(Conotoxin)和蜘蛛(Spider)数量最多,分别是969和975条(图三)(The Knottin database(inserm.fr))。
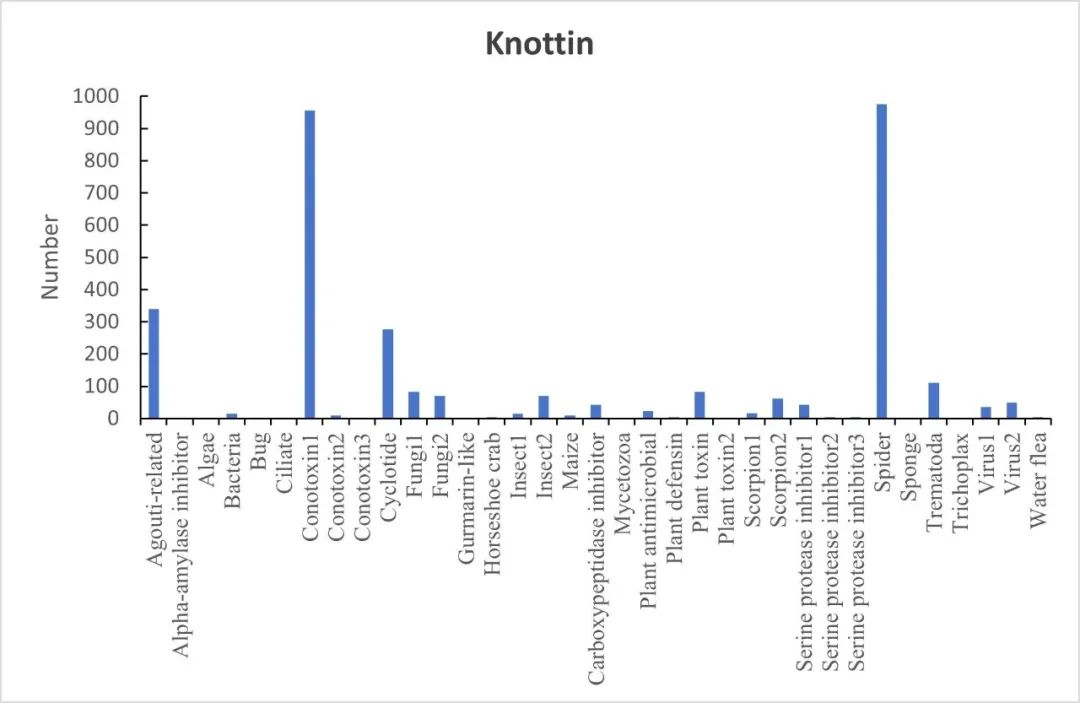
图三 Knottin的35个家族和多肽数量(The Knottin database (inserm.fr) )
天然存在的Knottin具有广泛的药理活性[14]。Ziconotide于20世纪80年代初被Baldomero Olivera发现;1990年,美国公司Neurex Corp申请专利US5189020A,也叫SNX-111;1998年,爱尔兰公司Elan Corporation收购Neurex;在2004年,首个Knottin药物被FDA批准,药物名为Ziconotide/Prial(https://www.prialt.com/),提取自芋螺神经毒素,能阻断钙离子通道,被用于治疗慢性疼痛。
此外,有研究表明,Knottin与癌症特异性靶点结合后,具有极高的体内稳定性、高靶点亲和力、良好的组织分布和快速的体内清除能力,在开发成像和治疗药物的应用中非常有前途。比如,2007年,用蝎子毒液中的一种成分——氯毒素(CTX)开发了第一种用作分子成像剂的knottin。在动物模型中,Cy5.5-CTX被证明能有效检测胶质瘤、髓母细胞瘤、前列腺和肠道肿瘤[15]。由于 CTX 天然含有多个赖氨酸残基,染料分子通过游离氨基轭合会导致标记肽的异质混合物。为了解决这个问题,用丙氨酸或精氨酸残基代替赖氨酸,从而得到了每条肽含有一个染料分子的均质标记产品。一种与吲哚菁绿偶联的改良版CTX (Tozuleristide,BLZ-100)目前正被评估为一种用于诊断和术中肿瘤可视化的工具,是胶质瘤和其他类型肿瘤荧光引导手术的候选分子,于2015年获得孤儿药地位,目前处于临床Ⅲ期[16]。
综上所述,knottin具有作为药物应用所需的三个基本特征:优异的稳定性,高亲和力或抑制活性以及对靶点的高选择性。并且knottin中三个二硫键形成的骨架具有显著的序列耐受性,可以在其环区引入新的官能团,通常不会丧失结构的完整性和生物活性。knottin凭借这些优势在医学领域中大放异彩。
3、Knottin的新药开发
Knottin凭借优秀的成药特质,开启了新药开发的历程。
3.1 开发镇痛药物的应用
一般而言,双靶点RDC的靶点应选择两个表达中等、表达量分布差异不太大且有互补作用的靶点。如果一个靶点表达很高,另一靶点表达很低,无法达到协同作用目的及扩展应用范围。此外,还要结合内化及肿瘤机制的不同,进行合理偏向性设计。αvβ3/FAP是一种好的靶点组合,在多种肿瘤过表达,双靶RDC [68Ga]Ga-FAPI-RGD(图2)在胰腺癌的小鼠CDX模型中显示很好的肿瘤组织摄取率(图3、4)[4-6],显著高于单靶RDC [68Ga]Ga-RGD及[68Ga]Ga-FAPI-02。在多种癌症初步的人体试验结果表明,较18F-FDG能显示更多的转移病灶(图5)[7]。芋螺通过分泌毒液来捕食猎物和防御天敌,每种芋螺的毒液中含有约2000种不同的小肽,称为芋螺毒素(conopeptide或conotoxin)。芋螺毒素是迄今为止发现的分子量最小的一类多肽毒素,通常由10~40个氨基酸残基组成,具有分子量小、半胱氨酸丰富、序列多变、靶点专一等特点。芋螺毒素能特异地作用于电压门控或配体门控离子通道,因此有望成为神经科学研究的新型工具和治疗相关疾病的新型药物。
2004年,基于ω-芋螺毒素(ω-MVIIA)开发的非阿片类镇痛药ziconotide被美国FDA批准上市,这是首个获批的knottin类药物,商品名为Prialt(尚未在中国上市)。ziconotide包含25个氨基酸残基(图四),作用靶点是N-型钙离子通道CaV2.2,用于缓解严重慢性疼痛,效力是吗啡的1000倍,而且不具备成瘾性和耐受性,通过鞘内注射给药。ziconotide结合到脊髓背角上的浅层(Rexed纹层I和II)与主疼痛觉(A-δ和C)神经纤维相关的N-型钙离子通道,从而阻断脊髓 N-型钙离子通道,进而抑制初级传入神经元中枢终端释放与疼痛相关的神经递质,发挥镇痛作用。
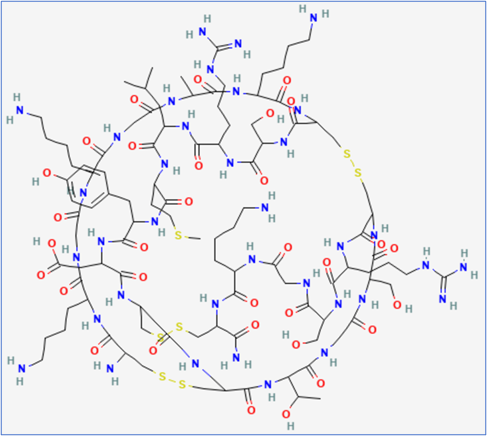
图四 ziconotide平面结构图
同时,颜宁教授团队2021年在Nature上发表一篇名为《Structure of human Cav2.2 channel blocked by the painkiller ziconotide》,进一步揭示了ziconotide与人类N-型电压门控钙离子通道Cav2.2相结合时的结构,研究发现ziconotide能选择性地抑制Cav2.2,它并没有完全封堵钙离子的进出通道,而是通过中和通道外部的电负性,为钙离子进入通道设置结构上的障碍(图五)[17]。
图五 ziconotide对 Cav2.2 的特异性孔道阻断
3.2 开发口服药物的应用
口服给药是一种优先选择的给药途径,因为增加了患者的依从性,但这也是多肽药物开发所面临的最大瓶颈。与大多数多肽治疗药物不同,Knottin优越的稳定性表明它们在暴露于胃肠道后仍可能保留其生物活性,拥有开发成口服药物的强大潜力。
有研究发现来自海绵Asteropus sp的4种不同的Knottin(asteropsin A-D)具有高度保守的结构框架,对胃肠道酶(糜凝胰蛋白酶、弹性酶、胃蛋白酶和胰蛋白酶)和人血浆中的酶具有显著的稳定性,Asteropsins是一种很有前途的具有口服生物利用度的多肽支架[18]。
此外,2012年,第二个Knottin药物被FDA批准,药物名为linaclotide/Linzess(https://www.linzess.com/),是一种合成的口服肽药物,为首个高亲和力鸟苷酸环化酶C激动剂(GCCA),由14个氨基酸组成(图六),用于治疗慢性特发性便秘和便秘型肠易激综合征,并且在中国也已上市。linaclotide通过激活鸟苷酸环化酶-C(GC-C)在胃肠道中引起局部药理反应,鸟苷酸环化酶-C是一种主要表达于整个肠道上皮细胞管腔表面的受体。GC-C的刺激导致细胞内下游效应物环鸟苷-3′,5′-单磷酸(cGMP)水平的积累。cGMP水平的升高会刺激肠腔内水和电解质的分泌,从而加速胃肠道的蠕动,缓解便秘;它还能抑制结肠痛觉感受器,从而减轻腹痛。Linaclotide的上市,无疑是证实了Knottin具备开发成口服药物的能力。

图六 Linaclotide平面结构图
3.3 开发可穿透血脑屏障(BBB)药物的应用
CTX分离自巨型黄色以色列蝎子Leiurus quinquestriatus的毒液,是一种含36个氨基酸的多肽,含有Knottin的稳定结构,可与ICG共价结合。同时,CTX被证明可以促进纳米颗粒穿透血脑屏障(BBB),这表明该肽或许能够穿透BBB到达功能未受损的脑肿瘤中[19]。由Blaze Bioscience公司开发的Tozuleristide(BLZ-100),是一种肿瘤靶向成像剂,由靶向肽与近红外荧光染料吲哚菁绿(ICG)相连而成,用于小儿原发性中枢神经系统肿瘤的荧光引导手术(FGS),于美国时间2022年11月2日宣布完成Tozuleristide临床Ⅱ/Ⅲ期受试者招募工作,目前处于临床Ⅲ期,同时还将适应症扩展至口腔鳞状细胞癌和高度口腔发育不良进行的成像及中枢神经系统肿瘤的FGS。Tozuleristide的靶向肽是基于氯毒素(CTX)优化而来,经过修饰后进一步增强了荧光染料的附着力。临床Ⅰ期结果显示接受神经外科手术的患者对剂量高达30毫克的Tozuleristide依旧表现出良好的耐受性,并且对胶质瘤的FGS有效,在给药后的几个小时内就可以达到造影剂的效果(图七)[20]。因此,在开发可穿透血脑屏障的药物方面,Knottin也具备相应的潜力。
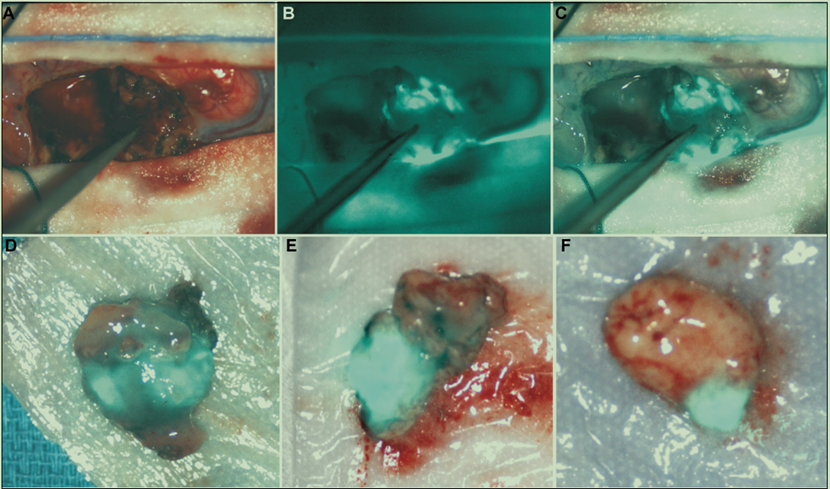
图七 来自Tozuleristide 受试者T303(胶质母细胞瘤)的原位和离体的SIRIS图像
4、总结与展望
Knottin自从几十年前被发现以来,就引起了基础科学界和制药行业的极大兴趣。人们对许多天然存在的Knottin的生物化学和生物物理特性进行了研究,其分子小,具有卓越的化学、热和蛋白水解稳定性的特点,可以有效克服现有多肽药物较难透过组织屏障以及无法口服的限制,在临床治疗领域应用广泛。然而在开发Knottin药物时仍存在几个问题有待解决,如:已有的上市Knottin药物证实其具有非免疫原性的,但由于其结构复杂,在药物开发时还是需要注意其本身的免疫原性;已上市的口服药物Linaclotide的口服生物利用度仅为0.1%,需要对Knottin的药物制剂、给药以及用于药物递送方面进行更深入的研究以提高口服利用度。虽然Knottin存在着上述一些待解决的问题,但凭借其优秀的成药特性,仍具有广泛的开发前景。
参考文献
- 1. Sarah J. Moore, Cheuk Lun Leung, Jennifer R. Cochran. Knottins: disulfide-bonded therapeutic and diagnostic peptides. Drug Discov Today Technol. 2012 Spring;9(1):e1-e70. doi: 10.1016/j.ddtec.2011.07.003. PMID: 24064239.
- 2. Ackerman SE, Currier NV, Bergen JM, Cochran JR. Cystine-knot peptides: emerging tools for cancer imaging and therapy. Expert Rev Proteomics. 2014 Oct;11(5):561-72. doi: 10.1586/14789450.2014.932251. Epub 2014 Aug 28. PMID: 25163524.
- 3. Colgrave ML, Craik DJ. Thermal, chemical, and enzymatic stability of the cyclotide kalata B1: the importance of the cyclic cystine knot. Biochemistry. 2004 May 25;43(20):5965-75. doi: 10.1021/bi049711q. PMID: 15147180.
- 4. Werle M, Schmitz T, Huang HL, Wentzel A, Kolmar H, Bernkop-Schnürch A. The potential of cystine-knot microproteins as novel pharmacophoric scaffolds in oral peptide drug delivery. J Drug Target. 2006 Apr;14(3):137-46. doi: 10.1080/10611860600648254. PMID: 16753827.
- 5. Kolmar H. Natural and engineered cystine knot miniproteins for diagnostic and therapeutic applications. Curr Pharm Des. 2011 Dec;17(38):4329-36. doi: 10.2174/138161211798999465. PMID: 22204431.
- 6. Gracy J, Le-Nguyen D, Gelly JC, Kaas Q, Heitz A, Chiche L. KNOTTIN: the knottin or inhibitor cystine knot scaffold in 2007. Nucleic Acids Res. 2008 Jan;36(Database issue):D314-9. doi: 10.1093/nar/gkm939. Epub 2007 Nov 19. PMID: 18025039; PMCID: PMC2238874.
- 7. Attah FA, Lawal BA, Yusuf AB, Adedeji OJ, Folahan JT, Akhigbe KO, Roy T, Lawal AA, Ogah NB, Olorundare OE, Chamcheu JC. Nutritional and Pharmaceutical Applications of Under-Explored Knottin Peptide-Rich Phytomedicines. Plants (Basel). 2022 Nov 28;11(23):3271. doi: 10.3390/plants11233271. PMID: 36501311; PMCID: PMC9737898.
- 8. Wilczynski AM, Joseph CG, Haskell-Luevano C. Current trends in the structure-activity relationship studies of the endogenous agouti-related protein (AGRP) melanocortin receptor antagonist. Med Res Rev. 2005 Sep;25(5):545-56. doi: 10.1002/med.20037. PMID: 16044415.
- 9. Rees DC, Lipscomb WN. Refined crystal structure of the potato inhibitor complex of carboxypeptidase A at 2.5 A resolution. J Mol Biol. 1982 Sep 25;160(3):475-98. doi: 10.1016/0022-2836(82)90309-6. PMID: 7154070.
- 10. Chiche L, Gaboriaud C, Heitz A, Mornon JP, Castro B, Kollman PA. Use of restrained molecular dynamics in water to determine three-dimensional protein structure: prediction of the three-dimensional structure of Ecballium elaterium trypsin inhibitor II. Proteins. 1989;6(4):405-17. doi: 10.1002/prot.340060407. PMID: 2622910.
- 11. Bode W, Greyling HJ, Huber R, Otlewski J, Wilusz T. The refined 2.0 A X-ray crystal structure of the complex formed between bovine beta-trypsin and CMTI-I, a trypsin inhibitor from squash seeds (Cucurbita maxima). Topological similarity of the squash seed inhibitors with the carboxypeptidase A inhibitor from potatoes. FEBS Lett. 1989 Jan 2;242(2):285-92. doi: 10.1016/0014-5793(89)80486-7. PMID: 2914611.
- 12. Le Nguyen D, Heitz A, Chiche L, Castro B, Boigegrain RA, Favel A, Coletti-Previero MA. Molecular recognition between serine proteases and new bioactive microproteins with a knotted structure. Biochimie. 1990 Jun-Jul;72(6-7):431-5. doi: 10.1016/0300-9084(90)90067-q. PMID: 2124146.
- 13. Gelly JC, Gracy J, Kaas Q, Le-Nguyen D, Heitz A, Chiche L. The KNOTTIN website and database: a new information system dedicated to the knottin scaffold. Nucleic Acids Res. 2004 Jan 1;32(Database issue):D156-9. doi: 10.1093/nar/gkh015. PMID: 14681383; PMCID: PMC308750.
- 14. Daly NL, Craik DJ. Bioactive cystine knot proteins. Curr Opin Chem Biol. 2011 Jun;15(3):362-8. doi: 10.1016/j.cbpa.2011.02.008. Epub 2011 Feb 27. PMID: 21362584.
- 15. Veiseh M, Gabikian P, Bahrami SB, Veiseh O, Zhang M, Hackman RC, Ravanpay AC, Stroud MR, Kusuma Y, Hansen SJ, Kwok D, Munoz NM, Sze RW, Grady WM, Greenberg NM, Ellenbogen RG, Olson JM. Tumor paint: a chlorotoxin:Cy5.5 bioconjugate for intraoperative visualization of cancer foci. Cancer Res. 2007 Jul 15;67(14):6882-8. doi: 10.1158/0008-5472.CAN-06-3948. PMID: 17638899.
- 16. Fidel J, Kennedy KC, Dernell WS, Hansen S, Wiss V, Stroud MR, Molho JI, Knoblaugh SE, Meganck J, Olson JM, Rice B, Parrish-Novak J. Preclinical Validation of the Utility of BLZ-100 in Providing Fluorescence Contrast for Imaging Spontaneous Solid Tumors. Cancer Res. 2015 Oct 15;75(20):4283-91. doi: 10.1158/0008-5472.CAN-15-0471. PMID: 26471914; PMCID: PMC4610180.
- 17. Gao S, Yao X, Yan N. Structure of human Cav2.2 channel blocked by the painkiller ziconotide. Nature. 2021 Aug;596(7870):143-147. doi: 10.1038/s41586-021-03699-6. Epub 2021 Jul 7. PMID: 34234349; PMCID: PMC8529174.
- 18. Li H, Bowling JJ, Su M, Hong J, Lee BJ, Hamann MT, Jung JH. Asteropsins B-D, sponge-derived knottins with potential utility as a novel scaffold for oral peptide drugs. Biochim Biophys Acta. 2014 Mar;1840(3):977-84. doi: 10.1016/j.bbagen.2013.11.001. Epub 2013 Nov 10. PMID: 24225326; PMCID: PMC4139099.
- 19. Veiseh O, Sun C, Fang C, Bhattarai N, Gunn J, Kievit F, Du K, Pullar B, Lee D, Ellenbogen RG, Olson J, Zhang M. Specific targeting of brain tumors with an optical/magnetic resonance imaging nanoprobe across the blood-brain barrier. Cancer Res. 2009 Aug 1;69(15):6200-7. doi: 10.1158/0008-5472.CAN-09-1157. Epub 2009 Jul 28. PMID: 19638572; PMCID: PMC2742601.
- 20. Patil CG, Walker DG, Miller DM, Butte P, Morrison B, Kittle DS, Hansen SJ, Nufer KL, Byrnes-Blake KA, Yamada M, Lin LL, Pham K, Perry J, Parrish-Novak J, Ishak L, Prow T, Black K, Mamelak AN. Phase 1 Safety, Pharmacokinetics, and Fluorescence Imaging Study of Tozuleristide (BLZ-100) in Adults With Newly Diagnosed or Recurrent Gliomas. Neurosurgery. 2019 Oct 1;85(4):E641-E649. doi: 10.1093/neuros/nyz125. PMID: 31069381.
*声明:本文仅是介绍医药疾病领域研究进展或简述研究概况或分享医药相关讯息,并非也不会进行治疗或诊断方案推荐,也不对相关投资构成任何建议。



