¹⁷⁷Lu-PSMA-617治疗mCRPC反应不足的原因分析及破局策略探讨
发布时间:
2025-08-29
作者:
汤俊颖,中晟全肽研发战略部研究员
引言
转移性去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer,mCRPC)是前列腺癌(prostate cancer,PCa)发展的终末阶段,患者预后极差,使用传统治疗手段如化疗、内分泌治疗等疗效有限。亟需更精准、高效的治疗方案来改善患者生存质量与延长生存期,且据弗若斯特沙利文预测,2030年全球mCRPC 患病数将达208万例,患者群体庞大。
2022年,靶向前列腺特异性膜抗原(prostate specific membrane antigen,PSMA)的放射性配体疗法Pluvicto@(177Lu-PSMA-617)的获批,为mCRPC患者带来了新的希望,使mCRPC的治疗有了里程碑进展。大量的临床试验数据证明,确定患者PSMA阳性对于Pluvicto@的靶向治疗至关重要。因此,在Pluvicto@进行靶向治疗前,将使用PSMA正电子发射断层扫描进行分子影像确证。然而综合临床疗效数据来看,仍有约30%的mCRPC患者对Pluvicto@治疗无反应。这意味着,尽管该疗法可使部分患者获益,但仍有大量患者未能跨越治疗响应的门槛,极大限制了其疗效的发挥,这可能归因于PSMA的表达异质性或缺失[1]。因此,深入探究这一现象的底层逻辑,寻找的破局之路,成为当前临床与科研领域的重要课题。
本文将从mCRPC患者对Pluvicto@治疗未完全反应这一临床问题出发,先系统分析导致无反应的原因,包括PSMA表达异质性、表达水平不足及治疗中动态下降等;随后,详细阐述目前针对这些原因的应对策略,包括联合用药、更换核素及开发双特异性放射性核素配体等,旨在为深入理解这一治疗难题以及探索有效的解决方案提供清晰的思路与方向。
1、为何约30%的mCRPC患者对Pluvicto@治疗无反应?
1.1 PSMA表达的异质性
针对PSMA的靶向治疗(如:放射性配体疗法(Radioligand Therapy,RLT))主要依赖于 PSMA的表达来发挥作用,若肿瘤中存在大量低/不表达PSMA的细胞,这些细胞可能逃避治疗,导致肿瘤残留或复发,从而降低治疗响应率,这也是临床中需要关注肿瘤内部标志物表达差异、优化治疗方案的重要原因之一。PSMA 表达异质性的特点存在多层复杂性,如可以在细胞、肿瘤或空间、患者间、患者内、谱系内、谱系间和时间维度观察到(见图1)。
细胞异质性是指单个肿瘤细胞内的变异性,其会随着时间的推移而演变,又称为时间细胞异质性。空间或肿瘤内异质性描述了同一肿瘤在不同区域内的变异性.。患者内异质性捕捉了同一患者体内多个肿瘤之间的变异,与患者间异质性形成鲜明对比,后者是不同个体之间肿瘤的变异性。而谱系内异质性侧重于同一患者内单细胞谱系内随时间的变化,这强调了PCa中 PSMA 表达的动态性质以及细致入微的治疗方法的必要性。有文献进一步验证了PSMA表达异质性的存在,在对52例mCRPC患者的636个转移灶样本进行分析时发现,这些转移灶中PSMA的表达主要分为3种模式:25%低/阴性(H-score≤20)、44%异质性(同时包含低/阴性和高表达转移灶)、31%高表达(H-score>20)[2]。同时,部分mCRPC患者的肿瘤细胞PSMA表达水平极低,甚至不表达,而且在单个转移灶切片中也可以观察到PSMA表达高低不同的区域,这说明作为PSMA的靶向药Pluvicto@无法特异性地识别并结合所有肿瘤细胞,自然也就难以尽全力治愈整个肿瘤。
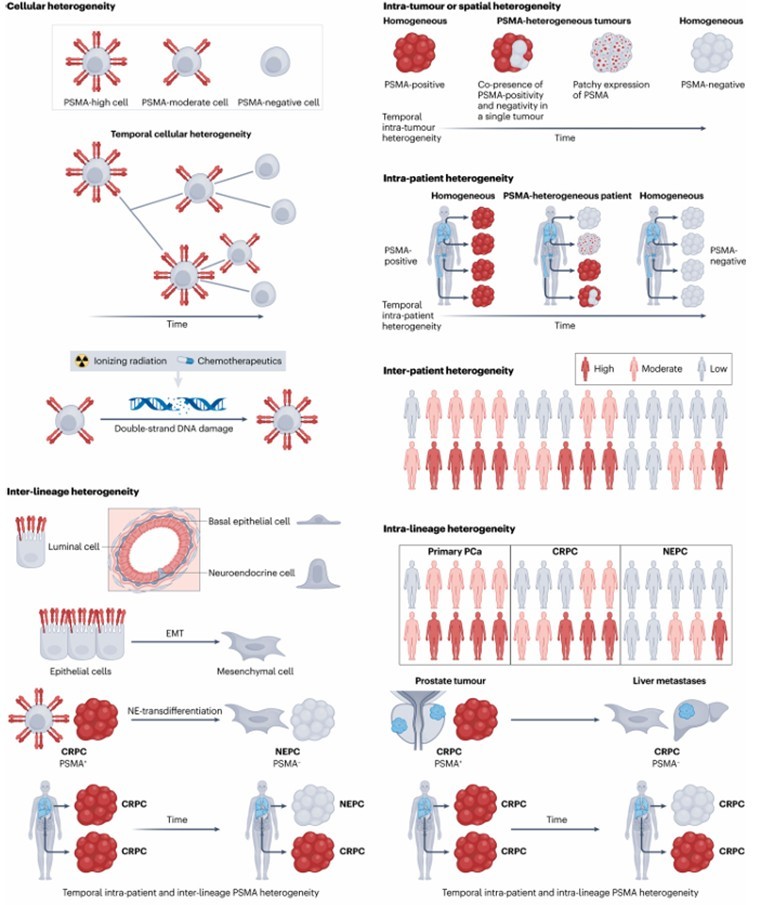
图1 不同水平PSMA表达异质性示意图
1.2 PSMA的表达水平不足
与PSMA表达异质性不同的是,PSMA 表达水平不足也是导致 Pluvicto®治疗响应率受限的重要原因。有研究对85例接受177Lu-PSMA-617治疗的患者进行分析(所有患者均接受了治疗前68Ga-PSMA-PET-CT扫描)[3],结果发现PSMA平均表达水平高的患者比PSMA平均表达水平低的患者生存期更长(15.1个月 vs 5.3个月,见图2),转移灶PSMA表达水平较低患者相比表达水平较高患者的生存期更短(7.9个月 vs 21.3个月),这表明高 PSMA 表达患者接受177Lu-PSMA-617治疗后生存期能得到显著延长,而PSMA表达水平不足则会严重影响治疗效果。
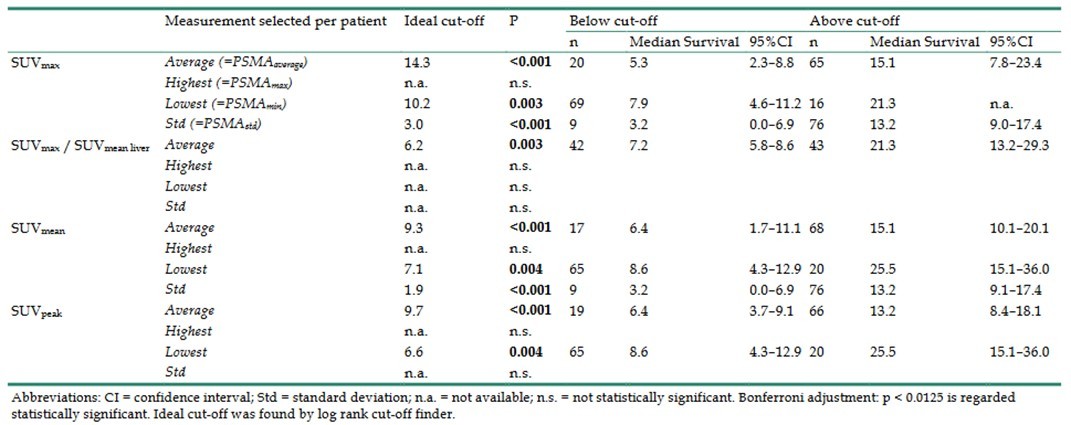
图2 基于不同PSMA-PET参数的二值化分组结果与总体生存率,注:PSMAmax(最高PSMA表达转移灶的SUVmax)、PSMAmin(最低PSMA表达转移灶的SUVmax)、PSMAaverage(所有转移灶的平均SUVmax);采用Log-rank截断值查找器确定低PSMA平均值(lowPSMAaverage)和高PSMA平均值(highPSMAaverage),以及低PSMA最小值(lowPSMAmin)和高PSMA最小值(highPSMAmin)
1.3 治疗中PSMA表达动态下降
药代动力学/药效动力学(PK/PD)模型证实,治疗周期内肿瘤对177Lu-PSMA-I&T的摄取量呈进行性下降,导致后续治疗疗效衰减[4]。这种动态变化可能与肿瘤细胞死亡和/或PSMA受体表达下降相关。评估放疗后PCa病灶中 PSMA的PET/CT 扫描信号的动力学变化发现,受照射病灶中的 PSMA 摄取量会随着时间逐渐下降,通常在治疗后9至12个月达到最低水平。这与氟代脱氧葡萄糖(18F-FDG)PET 形成对比,18F-FDG摄取量通常在3至4个月内达到最低点。PSMA 摄取量下降较慢表明,治疗后早期(尤其是3个月内)的 PSMA 的PET/CT 扫描可能会高估残留疾病,这有可能导致误诊或过度治疗。此外,还观察到前列腺或前列腺床病灶中的 PSMA 摄取量下降往往比骨或淋巴结病灶中的 PSMA 摄取量下降更慢,在解读放疗后PSMA PET/CT扫描结果时,应考虑到这种部位特异性差异。放疗后约9个月仍持续存在的摄取与随访影像学检查中获得完全局部缓解(L-CR)的可能性较低相关,这表明可能存在残留的存活疾病。相反,许多早期有残留摄取的病灶在后续影像学检查中无需额外治疗就消失了,这与假性进展或治疗后炎症变化相符。这些研究结果强调了在使用 PSMA PET/CT评估治疗反应时,选择合适成像时机的重要性。准确解读 PSMA 信号动态变化有助于临床医生更好地评估局部控制情况,避免过早升级治疗,并为PCa患者制定最佳管理策略提供指导。
2、破局策略
为解决上述致使临床疗效不佳的原因,总结多数学者观点,认为先从精准诊断评估入手,然后优化治疗方案,采取联合治疗和研发新药物等治疗策略,以提高治疗效果。
2.1 精准诊断
治疗前PSMA阳性表达肿瘤患者的筛选和治疗过程的PSMA的变化检测,为制定治疗方案和治疗后的方案调整提供依据。目前用于筛选的以PET/CT 为主,而治疗后的PSMA检测多用SPET/CT。
⑴ 基线PSMA-PET/CT确定177Lu-PSMA疗法的适用性
加州大学旧金山分校的医学博士托马斯・A・霍普(Thomas A. Hope)以及该专家小组的成员一致认为,应使用 VISION标准—如果患者至少有一处病灶的PSMA摄取高于肝脏,则符合入选条件;如果任何一处病灶符合计算机断层扫描(CT)大小标准,但PSMA摄取低于肝脏,则被排除在外,从而来筛选符合条件的患者接受177Lu-PSMA-617治疗。这使得68Ga-PSMA-11和18F-DCFPyL这两种示踪剂会更受青睐,不过PSMA PET/ CT检测应在开始治疗前的3个月内进行,避免PSMA表达差异。为识别潜在地PSMA阴性肿瘤,尤其是患有肝脏疾病的患者,还应进行增强CT或MRI检查。该专家小组基于对前瞻性试验数据的回顾,仅依赖于PSMA-PET/ CT成像在1-9分的量表上评估了177Lu-PSMA-617在各种PCa临床场景中的合理使用情况[5]。而TheraP则同时使用 PSMA和18F-FDG PET/CT 对患者进行更严格的筛查。TheraP 要求至少有一处病灶的最大标准摄取值(SUVmax)≥20,并排除18F-FDG阳性但PSMA阴性的不一致病灶或任何 SUVmax<10的病灶的患者。由于这些更严格的阈值,TheraP中有27.4%的筛查患者因不符合成像标准而未入选,而 VISION 中这一比例仅为12.6%。TheraP 中的前列腺特异性抗原(PSA)下降50%(PSA50)的应答率也更高(66% vs 46%),这可能也反映了更具选择性的入选标准和肿瘤生物学特性[1]。
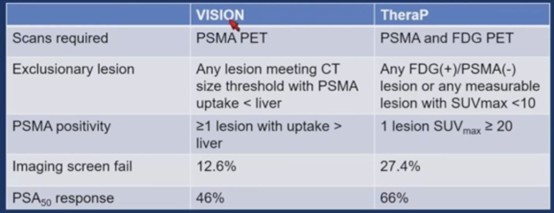
图3 比较VISION和TheraP两项临床研究的分子影像的入排标准和ORR结果
⑵ 用单光子发射计算机断层扫描SPECT/CT判断治疗后的效果
一些研究强调了177Lu-PSMA SPECT/CT和剂量测定法在预测RLT患者的疗效的潜在临床应用。首次治疗后SPECT/CT结果显示,38%的患者与治疗前PSMA PET/CT结果不一致,其中93.3%患者的PET/CT检查与治疗间隔超过30天,这表现了从基线PSMA PET/CT到第一个治疗周期期间出现疾病进展的患者。因此,对于那些在治疗前30天以上进行基线 PSMA PET/CT检查的患者,应在第一个周期后进行177Lu-PSMA全身SPECT/CT检查,并将该检查作为未来比较的新基线。
在2025年核医学与分子影像学会(SNMMI)年会上,一项研究发现,基线PSMA PET/CT应在第一个治疗周期后4周内完成,并且强烈支持对接受177Lu-PSMA治疗的患者进行治疗后SPECT/CT检查。 Pathmanadavel等人在177Lu-PSMA -RLT的第一和第三个周期后对177Lu-PSMA SPECT/CT进行定量分析后发现,从基线PSMA PET/CT至12周期间SPECT/CT总肿瘤体积增加30%,且与无进展生存期无关,从而可预测疾病进展。
2.2 优化治疗方案
⑴ 分层治疗
依据肿瘤的PSMA PET/CT表达水平(高、中、低)、疾病分期、身体状况等因素对患者进行分层。PSMA高表达且身体状况较好的患者,可采用较高剂量的 PSMA 靶向药物;对于 PSMA 低表达患者,适当降低剂量并联合其他治疗手段,避免过度治疗,同时提高治疗的针对性。
⑵ 动态调整治疗
依据治疗过程中肿瘤内PSMA表达(SPET/CT检测结果)的变化实时调整治疗方案。例如,在治疗一段时间后,通过再次成像检测PSMA 表达现状,若发现原本 PSMA 阳性的肿瘤区域转为阴性,可减少 PSMA 靶向药物剂量,增加其他针对阴性细胞的治疗方法,如化疗或免疫治疗。
2.3 完善治疗方法
目前,针对约30%的 mCRPC 患者对 Pluvicto@治疗无反应的问题,研究人员还开展了多方面的尝试,在联合用药、针对寡转移病灶的α核素药物开发和双靶点核素药物三个方面有明显进展。
⑴ 联合用药
①与免疫治疗结合:PRINCE phase 1试验评估了177Lu-PSMA-617联合帕博利珠单抗的安全性和有效性,具有一定疗效;EVOLUTION phase 2试验比较了177Lu-PSMA-617联合伊匹木单抗和纳武利尤单抗与单独177Lu-PSMA-617的效果。
②与化疗结合:LuCAB phase 1/2试验评估177Lu-PSMA-617联合卡巴他赛的最大耐受剂量等;UpFrontPSMA phase 2试验比较序贯使用177Lu-PSMA-617和多西他赛与仅使用多西他赛治疗转移性激素敏感性前列腺癌(mHSPC)的疗效。
③与放疗结合:有研究在探索177Lu-PSMA-617联合立体定向体部放疗用于寡转移性去势敏感性PCa的应用。
④与分子靶向治疗结合:LuPARP phase 1试验评估了177Lu-PSMA-617联合奥拉帕利的安全性和耐受性;LuPIN phase 1/2试验评估了177Lu-PSMA-617与依达诺昔尔的疗效,虽具有一定的效果但存在不良反应。
⑤与223Ra疗法结合:RALU 回顾性研究、WARMTH 多中心研究等显示177Lu-PSMA-617在接受过223RaCl2治疗的患者中耐受性良好。
⑥与雄激素受体通路抑制剂结合:ENZA-p phase 2试验将mCRPC患者随机分组,比较恩杂鲁胺单药与恩杂鲁胺联合177Lu-PSMA-617的效果,联合治疗组在前列腺特异性抗原无进展生存期、总生存期等方面更优[6]。
⑵ 开发alpha核素药物
相较于β核素,α核素发射的能量更高且作用范围更短,研究报道显示α射线的线性能量传递(LET)是β射线的100倍以上,可引发更密集的DNA双链断裂,能够更精准地摧毁癌细胞,同时减少对邻近组织的损伤。在177Lu-PSMA-617治疗后进展的mCRPC患者中,225Ac-PSMA-617仍能有效降低PSA水平[7]。然而,目前α核素供应不足是其面临的严峻问题。α核素的生产需要特殊的核反应堆设施,并且其生产过程复杂、成本高昂,这使得α核素的供应难以满足临床需求,从而限制了基于α核素的治疗方法的普及。
⑶ 开发双特异性配体核素药物
设计能够同时结合PSMA和其他肿瘤相关抗原或免疫细胞表面分子的双特异性抗体,这样不仅可以增强对PSMA阳性肿瘤细胞的靶向性,还能激活免疫细胞对肿瘤细胞的杀伤作用,克服因PSMA异质性导致的部分肿瘤细胞逃逸问题。并且选择与PSMA表达互补、且在PCa中具有明确致癌驱动作用的分子靶点,构建双特异性诊断治疗体系,也是研究的热点。目前已进入临床阶段的PSMA双靶组合包括PSMA/CD3、PSMA/STEAP1、PSMA/FAP、PSMA/GRPR等(见表1)。这些双靶的组合并非偶然,而是基于对肿瘤发生发展机制、各靶点生物学功能的深入研究。以PSMA和成纤维细胞活化蛋白-A(fibroblast activation protein,FAP)为例,PSMA在PCa细胞表面表达,而研究显示[8],FAP在多种肿瘤细胞(包含PCa)的基质中高表达,局部PCa中FAP表达水平较低,而晚期PCa中FAP表达显著升高,且在PSMA阴性的CRPC中,58%的患者FAP的表达呈阳性,(见图4)由于CRPC在治疗压力下可能失去PSMA表达,故此FAP可在晚期CRPC患者中作为替代PSMA或与PSMA联合成像和治疗的补充。
表1 处于临床阶段的PSMA双靶药物
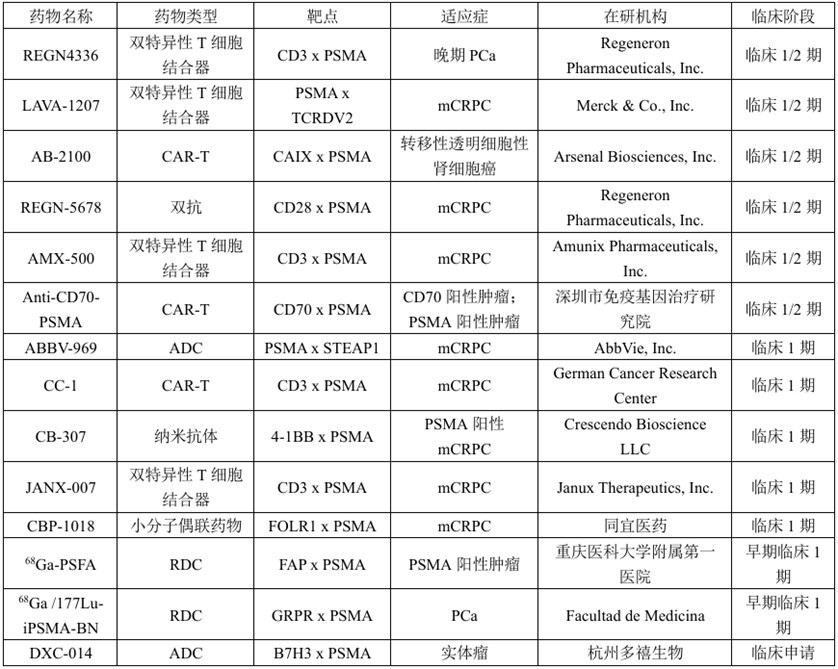
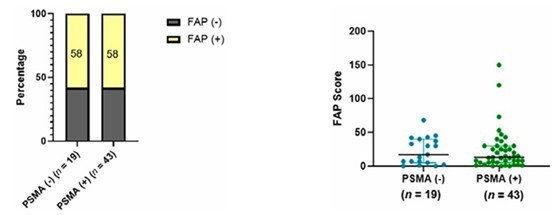
图4 左图:PSMA阴性和PSMA阳性CRPC中FAP 阳性病例的比例;右图:PSMA阴性和PSMA阳性CRPC中FAP的表达水平
3、结语:突破 Pluvicto@治疗瓶颈,迈向 mCRPC 精准治疗新征程
综上所述,PSMA在PCa细胞中的表达特征是制约Pluvicto@治疗响应率的核心因素。具体而言PSMA 的表达异质性显著,不仅不同患者、不同转移灶之间的 PSMA 表达水平差异明显,即便在同一病灶内,也可能出现 PSMA 高表达与低表达甚至阴性区域并存的情况,这直接导致靶向药物难以全面、特异性地结合肿瘤细胞,大幅削弱了治疗效果;当PSMA表达水平不足时,药物无法有效富集于肿瘤部位,患者的生存期也随之显著缩短,充分印证了蛋白表达量对治疗效果的关键影响;在治疗过程中,PSMA 表达还会出现动态下降的趋势,使得肿瘤对药物的摄取量逐步减少,造成后续治疗疗效衰减。
为突破这一治疗困境,联合用药通过不同作用机制药物的协同增效,有效延长了患者的无进展生存期,并显著提高了客观缓解率,为提升治疗效果提供了有力支撑;α核素凭借其更强的杀伤性和更精准的作用范围,在改善疗效方面展现出巨大潜力,然而,其普及却受限于供应不足这一现实难题;而双特异性放射性核素配体则通过多靶点协同,弥补了单一PSMA靶向的缺陷,为PSMA阴性或低表达患者提供了新的治疗可能。
未来,随着对肿瘤微环境复杂性、靶点间互作机制研究的不断深入,以及临床转化技术的持续进步,联合治疗方案的精细化优化、α核素生产技术的突破性进展以及双靶配体的大规模临床验证,将成为该领域的重点研究方向。这些探索不仅有望进一步提升 Pluvicto@的治疗响应率,更将为mCRPC患者的个体化治疗开辟全新路径,推动 mCRPC的治疗从“难治”逐步迈向“可控”,并朝着“可愈”的终极目标稳步前进。
参考文献
- 1.ASCO 2025: How to Get Lutetium-177 PSMA to Those That Will Most Benefit?
- 2.Sayar E, Patel RA, Coleman IM, Roudier MP, Zhang A, Mustafi P, Low JY, Hanratty B, Ang LS, Bhatia V, Adil M, Bakbak H, Quigley DA, Schweizer MT, Hawley JE, Kollath L, True LD, Feng FY, Bander NH, Corey E, Lee JK, Morrissey C, Gulati R, Nelson PS, Haffner MC. Reversible epigenetic alterations mediate PSMA expression heterogeneity in advanced metastatic prostate cancer. JCI Insight. 2023 Apr 10;8(7):e162907.
- 3.Seifert R, Seitzer K, Herrmann K, Kessel K, Schäfers M, Kleesiek J, Weckesser M, Boegemann M, Rahbar K. Analysis of PSMA expression and outcome in patients with advanced Prostate Cancer receiving 177Lu-PSMA-617 Radioligand Therapy. Theranostics. 2020 Jun 19;10(17):7812-7820.
- 4.Siebinga H, de Wit-van der Veen BJ, de Vries-Huizing DMV, Vogel WV, Hendrikx JJMA, Huitema ADR. Quantification of biochemical PSA dynamics after radioligand therapy with [177Lu]Lu-PSMA-I&T using a population pharmacokinetic/pharmacodynamic model. EJNMMI Phys. 2024 Apr 24;11(1):39.
- 5. Hope TA, Antonarakis ES, Bodei L, Calais J, Iravani A, Jacene H, Koo PJ, Morgans AK, Osborne JR, Tagawa ST, Taplin ME, Sartor O, Morris MJ. SNMMI Consensus Statement on Patient Selection and Appropriate Use of 177Lu-PSMA-617 Radionuclide Therapy. J Nucl Med. 2023 Sep;64(9):1417-1423.
- 6.Jadvar H, Rahbar K, Ahmadzadehfar H, Heidari P, Esfahani SA, Afshar-Oromieh A, Iravani A. Combination prostate-specific membrane antigen-targeted radiopharmaceutical therapy in metastatic prostate cancer. Q J Nucl Med Mol Imaging. 2025 Jun;69(2):174-179.
- 7.Rosar F, Hau F, Bartholomä M, Maus S, Stemler T, Linxweiler J, Ezziddin S, Khreish F. Molecular imaging and biochemical response assessment after a single cycle of [225Ac]Ac-PSMA-617/[177Lu]Lu-PSMA-617 tandem therapy in mCRPC patients who have progressed on [177Lu]Lu-PSMA-617 monotherapy. Theranostics. 2021 Feb 16;11(9):4050-4060.
- 8. Huang RR, Zuo C, Mona CE, Holzgreve A, Morrissey C, Nelson PS, Brady L, True L, Sisk A, Czernin J, Calais J, Ye H. FAP and PSMA Expression by Immunohistochemistry and PET Imaging in Castration-Resistant Prostate Cancer: A Translational Pilot Study. J Nucl Med. 2024 Dec 3;65(12):1952-1958.
*声明:本文仅是介绍医药疾病领域研究进展或简述研究概况或分享医药相关讯息,并非也不会进行治疗或诊断方案推荐,也不对相关投资构成任何建议。



