共价放射性核素偶联药物的研发进展
发布时间:
2025-09-28
作者:
戴秋云博士,中晟全肽研发战略部副总级顾问
引言
共价放射性核素偶联药物(简称共价RDC,covalent radioligand conjugates),即可以与作用靶标活性基团产生不可逆偶联反应的一类放射性核素偶联药物。该类药物因其具有高肿瘤摄取、不增加其他组织蓄积潜力而受到关注。本文简要介绍共价放射性核素偶联药物的研发进展,对该类药物研发中注意的问题进行了探讨,供从事放射性核素偶联药物的同仁参考。
1、共价RDC的作用机制及设计要求
1.1 作用机制
早在上世纪40年代,通过体内共价作用方式的药物就已出现,只是当时没有认识到是共价药物。本世纪2010年左右,共价药物受到重视,至2023年底,FDA批准的共价药物有128种[1],约占批准的小分子药物7%[1],适应症涵盖感染(抗生素)、癌症、心脏代谢性疾病、神经性疾病、免疫性疾病等。反应类型包括加成-消除、亲核取代、亲核加成及其他[1-3]。共价RDC的作用原理同一般共价药物,通过临近效应与靶蛋白反应(图1),增加RDC在肿瘤的滞留率,不改变或少改变分子在其他组织的循环、药代,从而减少对正常组织的损害。
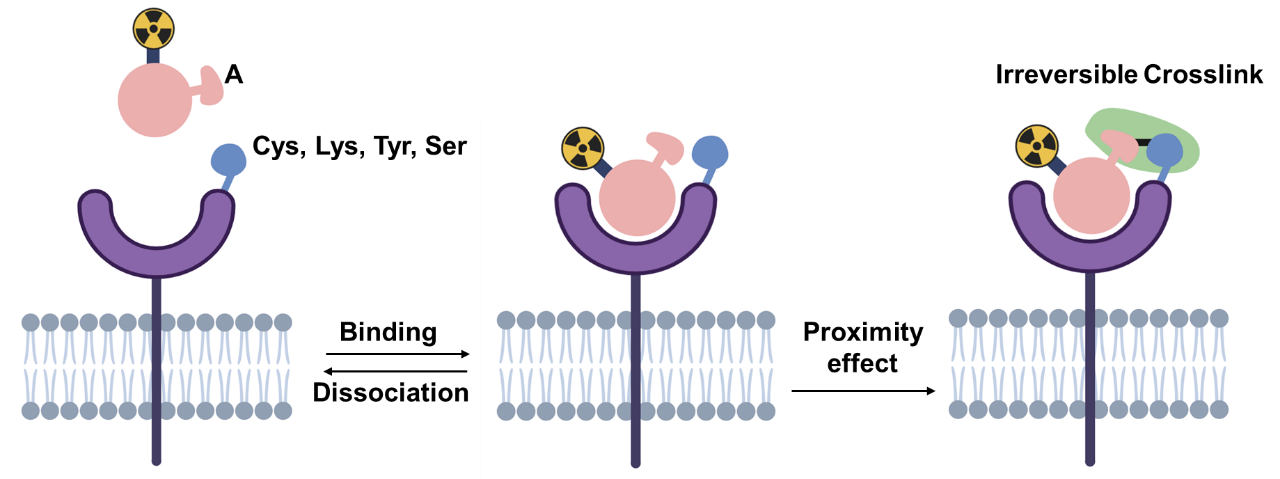
图1. 共价RDC的作用机制
1.2 共价RDC的设计要求
笔者认为共价药物设计应主要注意如下问题:
(1)共价RDC需与靶蛋白特异反应,非靶毒性低;
(2)反应基团不能干扰靶点蛋白的内吞活性;
(3)靶蛋白结合区的临近区域要有合适的作用基团,如Lys、Cys、Tyr、Ser等,据此选择合适的反应基团;
(4)设计时要对反应分子的活性进行调节,平衡反应活性与选择性,反应太快增加非特异性结合,反应速度太慢不能起到共价结合作用;
(5)设计的反应基团要靠近靶分子的作用基团,需要设计连接分子长度及位置。
2、共价RDC的研发进展
共价RDC是2020年左右作用出现的,涉及的靶点主要包括FAP、PSMA、KRAS[G12C]、NTSR1以及其他酶类靶标,如NCEH1丝氨酸蛋白水解酶、TGase 2(转谷氨酰胺酶2)、EGFR、ST14丝氨酸蛋白酶等(表1)[5-14]。其中针对在FAP、PSMA、KRAS[G12C]靶标的共价RDC取得较大进展,靶向FAP、PSMA具有临床发展潜力。共价RDC前肽主要来自于已报道的非共价抑制剂或共价抑制剂,再引入共价反应基团或放射配体络合物及核素,如DOTA、NOTA、68Ga、177Lu、86Y、18F、131I等。目前报道的共价RDC与靶分子的反应类型主要为氟代硫酸酯与Tyr的酯化、丙烯酰基及马来酰亚胺与巯基的加成、环氧乙烷与巯基的开环反应、酮苯并噻唑的加成与活性酯的酰胺化反应等[3,4]。一些共价RDC的结构见图2。
表1. 已报道的共价RDC[5-14]
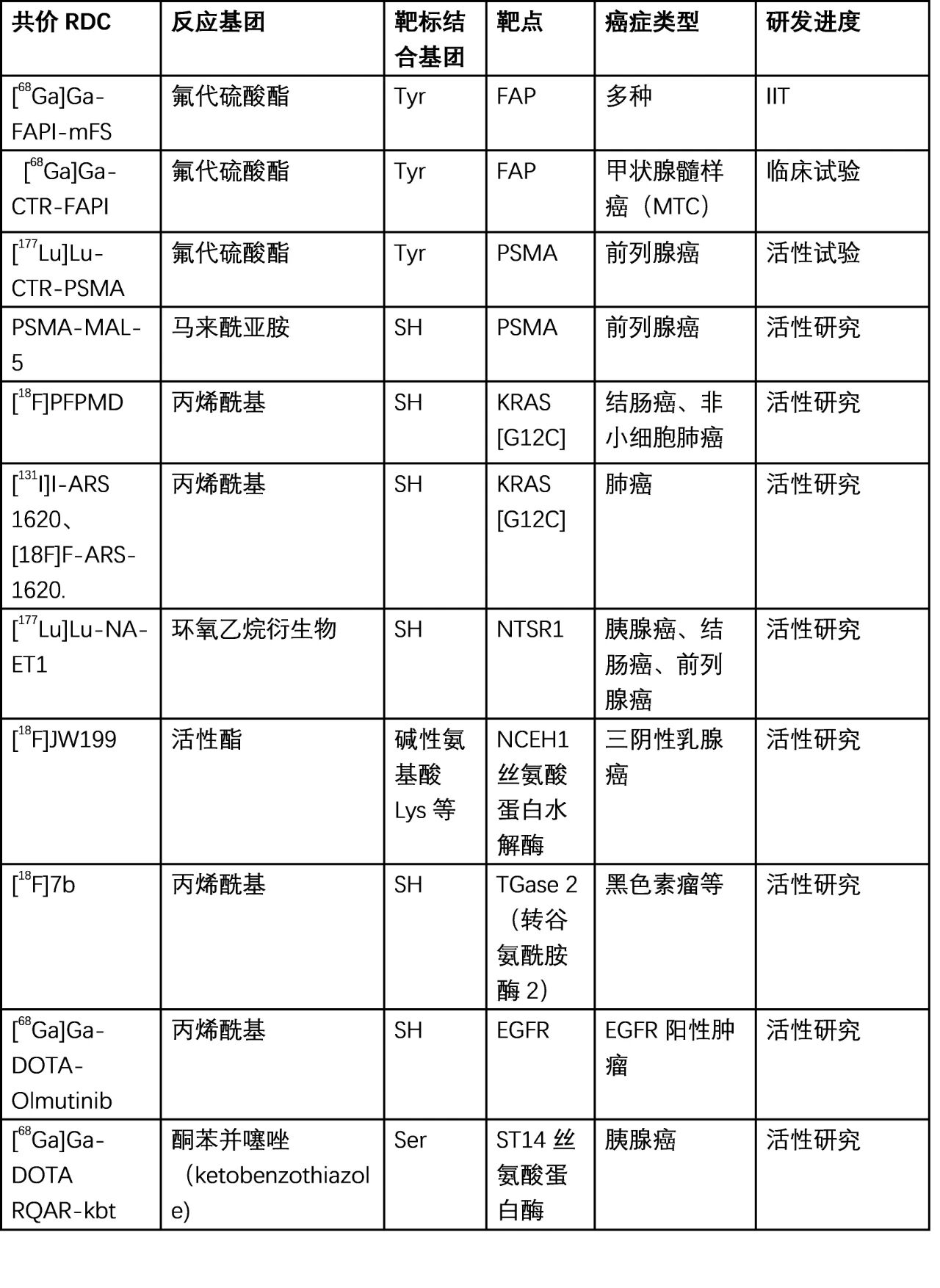
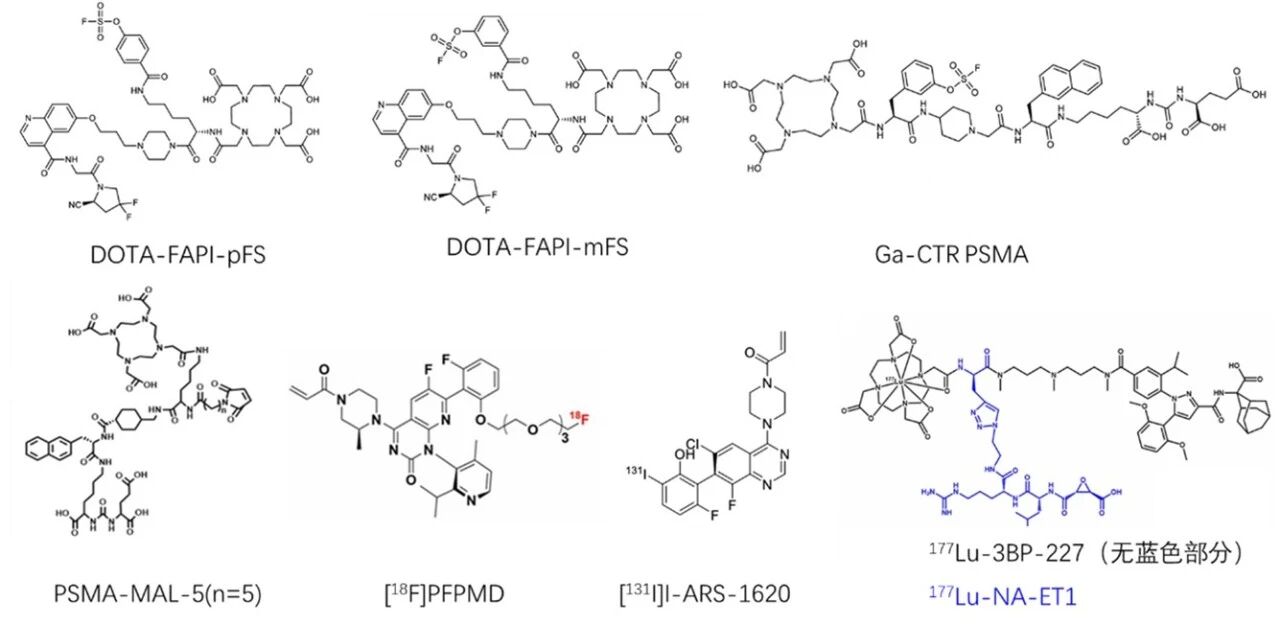
图2. 典型的共价RDC或前体肽结构图
2.1 靶向成纤维细胞活化蛋白(FAP)的共价RDC
采用小分子FAP结合小分子FAPI4,合成的氟代硫酸酯衍生物DOTA-FAPI-pFS及DOTA-FAPI-mFS(结构见图2)可分别与FAP的Y210及Y450作用形成共价偶联[5]。在小鼠模型中,[68Ga]Ga-DOTA-FAPI-mFS的肿瘤摄取比非共价RDC提高2倍多,且优于[68Ga]Ga-DOTA-FAPI-pFS,对转移性甲状腺髓样癌病人的检测灵敏度也显著提高(图3)[5]。
[86Y]Y-FAPI-mFS的肿瘤滞留时间明显长于[86Y]Y-FAPI-04。[177Lu]Lu-DOTA-FAPI-mFS对HT-1080-FAP荷瘤小鼠具有显著的抑瘤作用(图4)[5]。[68Ga]Ga-FAPI-mFS在甲状腺髓样癌(MIC)中也显示更好的肿瘤摄取,对患者的检测率显著高于[18F]-FDG(98%对66%,P=0.0002)[6]。基于DOTA-FAPI-mFS的多种核素的共价RDC的正常组织放射性蓄积较少,为其进入临床试验打下坚实基础。目前,兰州大学第二医院已开始进行177Lu-DOTA-FAPI-mFS的临床试验。
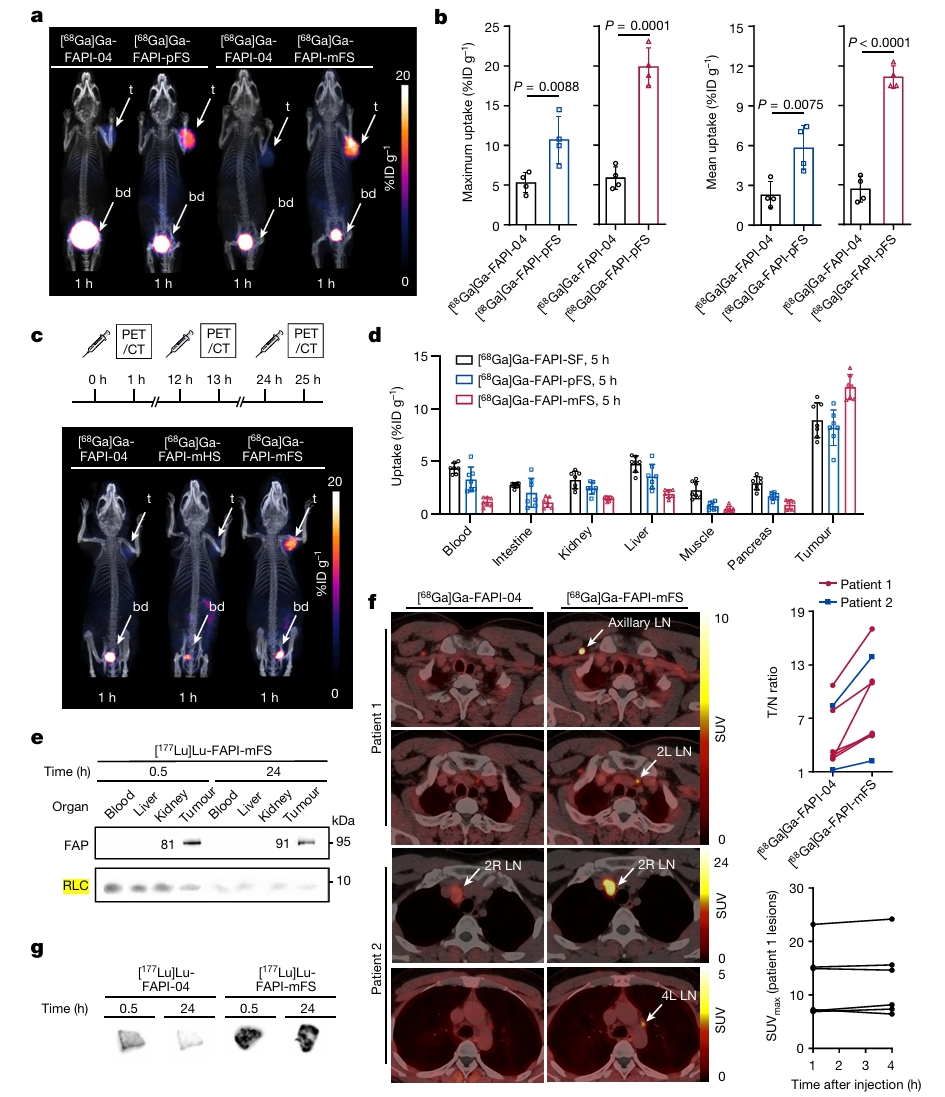
图3. FAP共价RDC 对HT-1080-FAP荷瘤小鼠的肿瘤摄取及对转移性甲状腺髓样癌病人的检测结果[5]
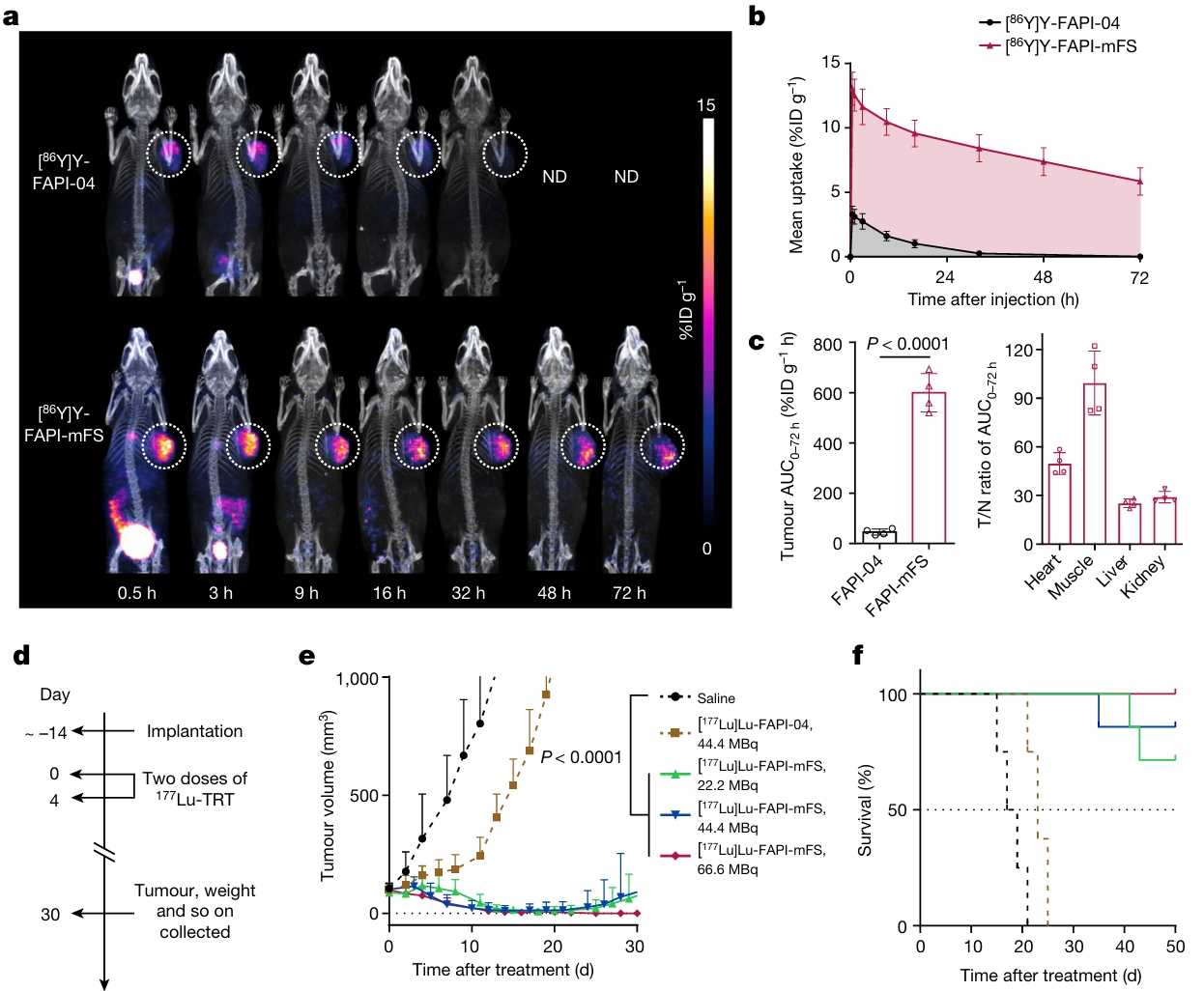
图4. FAP共价RDC(86Y及177Lu)对HT-1080-FAP荷瘤小鼠的肿瘤摄取及抑瘤作用[5]
2.2 靶向前列腺癌PSMA蛋白的共价RDC
采用氟代硫酸酯作为反应基团,对PSMA-617进行改造而合成的共价RDC [68Ga]Ga-CTR-PSMA(结构见图2),较[68Ga]Ga-PSMA-617具有更高的肿瘤摄取及抑瘤活性(图5)[5]。
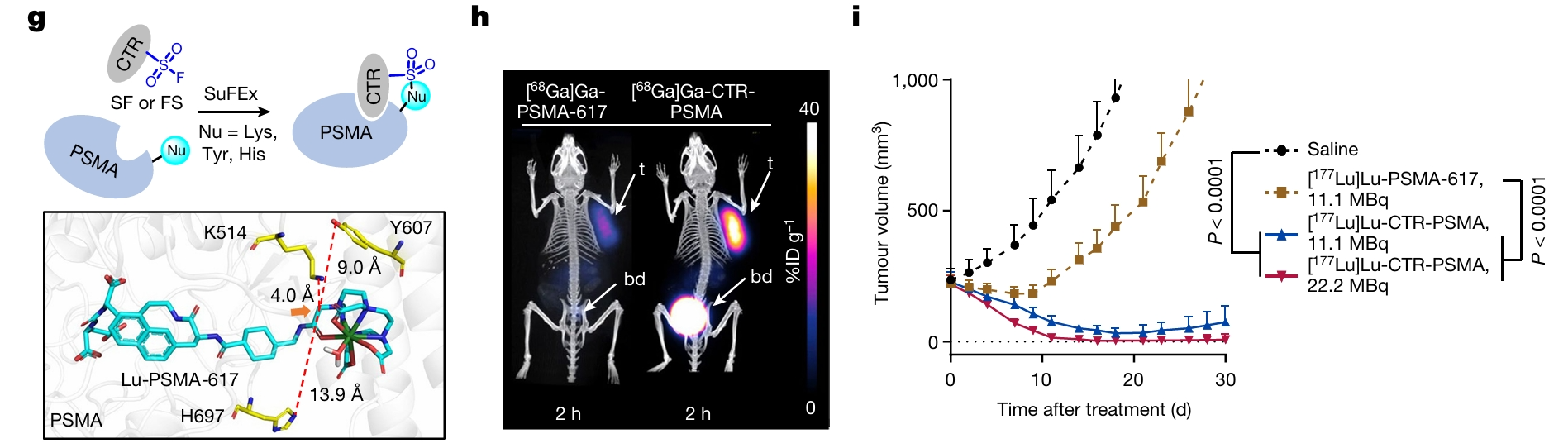
图5. [68Ga]Ga-CTR-PSMA、[177Lu]Lu-CTR-PSMA对PSMA阳性荷瘤小鼠的肿瘤的检测及抑瘤活性[5]
除氟代硫酸酯作为反应基团外,马来酰亚胺弹头也可作为反应基团,如PSMA-MAL-5(结构见图2)可与PSMA的Cys466偶联,而PSMA-MAL-1链太短不能接近 Cys466[7]。PSMA阳性LNCaP荷瘤鼠的体内分布显示,177Lu-PSMA-MAL-5较其他非共价RDC177Lu-PSMA-MAL-1、177Lu-PSMA-617、177Lu-PSMA-SUC-5(无双键结合基团)显著提高了肿瘤摄取,肿瘤/肌肉比更高(图6)[7]。进一步的小鼠体内抑瘤试验也证实,177Lu-PSMA-MAL-5具有显著的抑瘤活性,显著高于非共价RDC[7]。
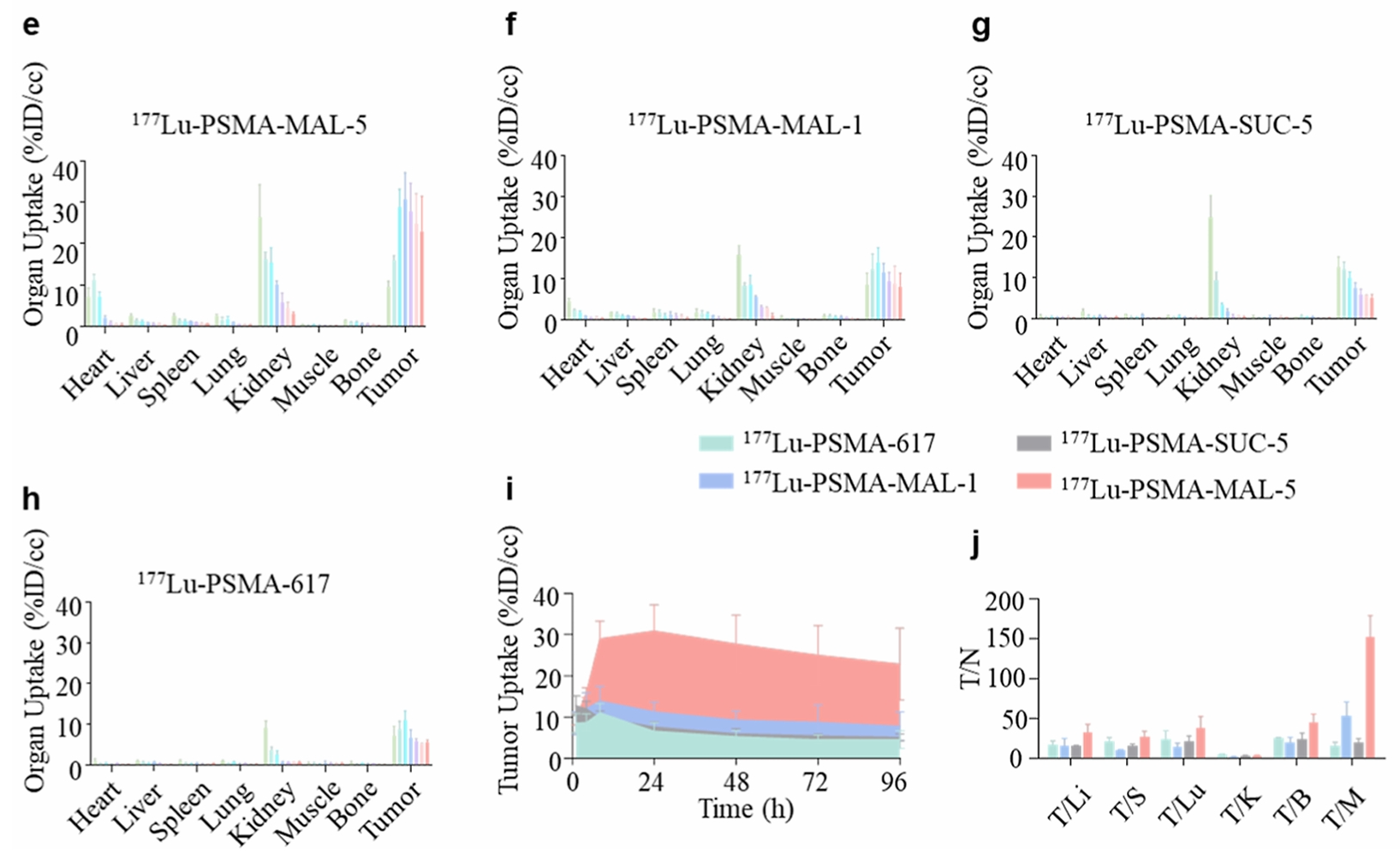
图6. PSMA共价RDC在前列腺癌LNCaP荷瘤鼠模型的组织分布[7]
2.3 靶向KRAS[G12C]的共价RDC
KRAS蛋白参与细胞信号转导并调控细胞增殖、分化,其突变导致蛋白持续活化,常见于结直肠癌、肺癌和胰腺癌等,其中KRAS[G12C]较为常见,导致耐药。目前已有KRAS[G12C]抑制剂Sotorasib(AMG510)、Adagrasib(MRTX849)用于非小细胞肺癌(NSCLC)及结直肠癌患者治疗。基于共价抑制剂Sotorasib而设计的共价RDC [18F]PFPMD可以检测到KRAS[G12C]突变肿瘤组织 [8]。以另一个KRAS[G12C]共价抑制剂ARS-1620而设计的共价RDC [131I]I-ARS-1620(结构见图2)等,对KRAS[G12C]突变阳性的非小细胞肺癌CDX模型具有一定的摄取,但肝及小肠的蓄积高(图7)[9]。
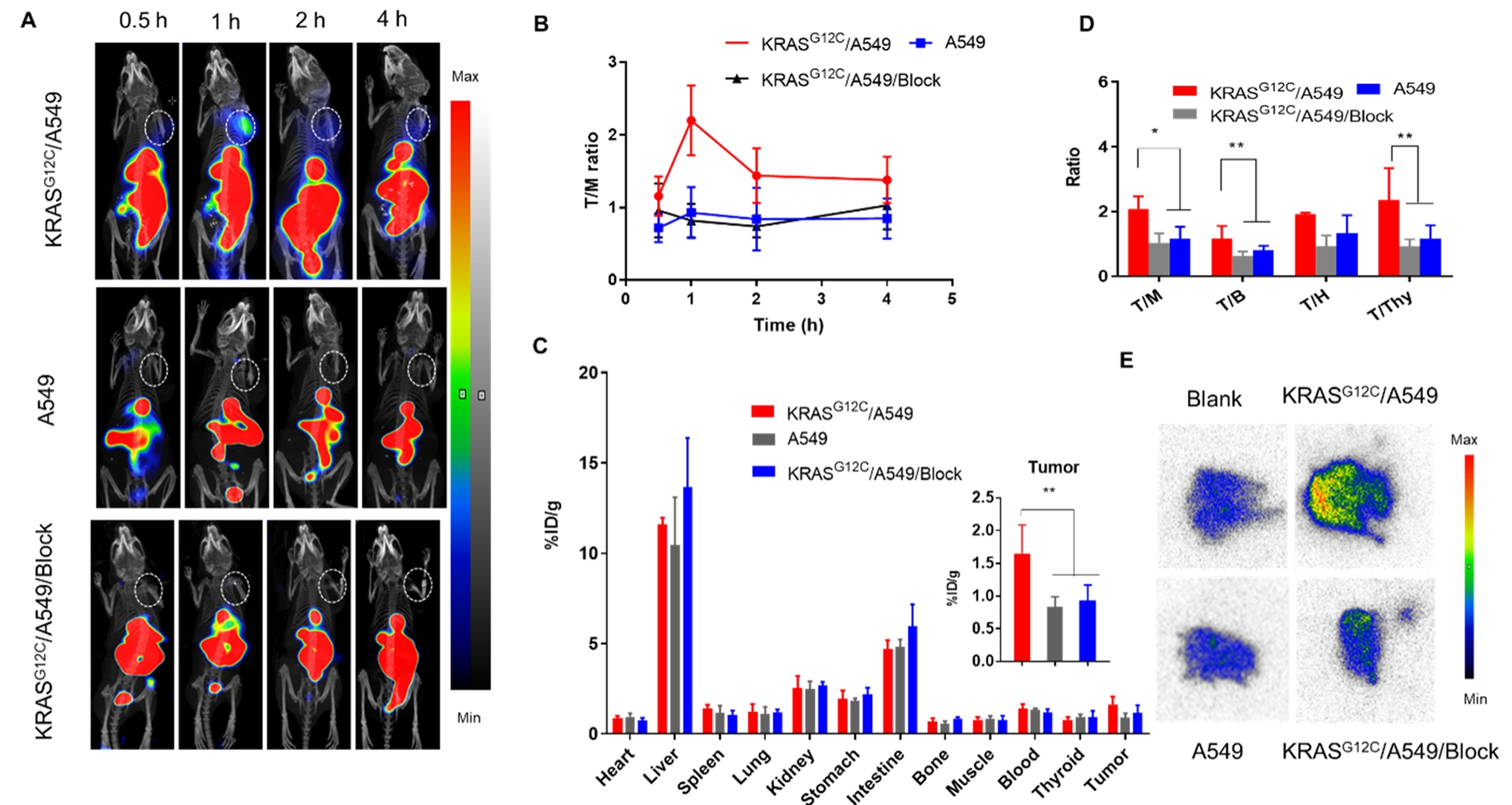
图7. KRAS[G12C]的共价RDC [131I]I-ARS-1620在非小细胞肺癌CDX模型的组织[9]
2.4 靶向神经紧张素受体1(NTSR1)的共价RDC
神经降压素受体亚型1(NTSR1)是神经降压素感受器家族中的一种G蛋白偶联受体。NTSR1的正常表达主要与中枢神经系统和胃肠道有关, 但NTSR1在胰腺导管腺癌(PDAC)、结直肠癌和前列腺癌等癌症中过表达。基于非共价RDC [177Lu]Lu-3BP-227设计的[177Lu]Lu-NAT1具有环氧乙烷结构(结构见图2),可与作用靶标附近的Cys发生不可逆反应。其在人结肠癌细胞系HT-29、胰腺癌细胞系AsPC-1和前列腺癌细胞系PC-3的CDX小鼠癌组织中的摄取较[177Lu]Lu-3BP-227增加了1.9-4.4倍(图8)[10]。
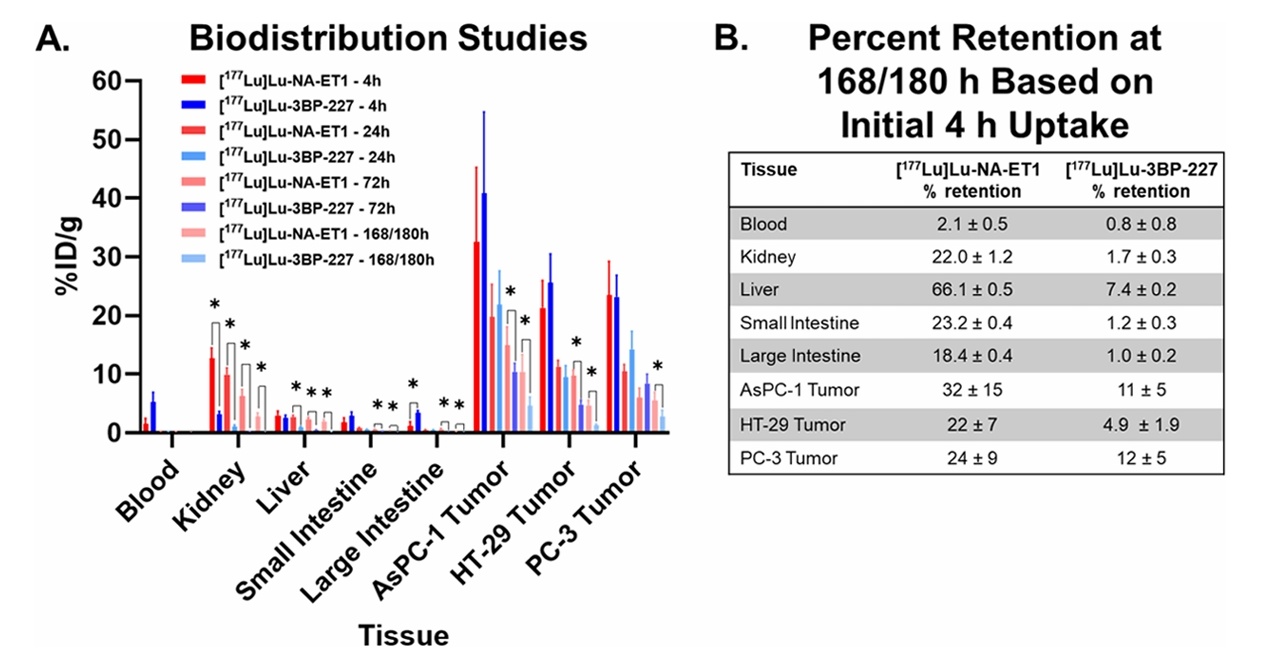
图8. NTSR1的共价RDC[177Lu]Lu-NAT1在几种癌症模型小鼠的组织分布[10]
2.5 靶向其他与肿瘤相关酶类的共价RDC
除前面介绍的几种共价RDC外,目前已报道靶向丝氨酸蛋白水解酶NCEH1的[18F]JW199[11]、靶向转谷氨酰胺酶2(TGase 2)的[18F]7b[12]、靶向EGFR的68Ga-DOTA-Olmutinib[13]及靶向丝氨酸蛋白酶ST14的[68Ga]Ga-DOTA-RQAR-kbt[14], 反应基团分别为活性酯、丙烯酰基、丙烯酰基、酮苯并噻唑。体外试验显示,各共价RDC的细胞摄取增加,模型小鼠肿瘤组织的RDC摄取有小幅增加,但正常组织的放射性蓄积增加明显,如68Ga-DOTA-Olmutinib在EGFR阳性CDX模型的肿瘤组织摄取较低,在肝脏、血液、心脏的蓄积高;[68Ga]Ga-DOTA-RQAR- kbt的肾蓄积比肿瘤摄取高。这些结果显示,并不是所有共价RDC均能显著增加肿瘤摄取,有时反而增加正常组织的放射性蓄积,需要仔细选择反应基团并合理设计共计抑制剂结构。
3、小结
目前,共价RDC还处于起步阶段(2020年后),报道较少。仅在FAP、PSMA、KRAS[G12C]、NSTR1等靶标中取得较大进展,靶向FAP、PSMA具有临床发展潜力,其他靶标(如TGase 2(转谷氨酰胺酶2)、EGFR、ST14丝氨酸蛋白酶等)的共价RDC效果不理想,肿瘤摄取不高或其他组织蓄积较高。此外,涉及的靶标及反应类型还较少,反应类型仅包括氟代硫酸酯与Tyr的酯化、丙烯酰基与巯基加成、马来酰亚胺与巯基的加成、环氧乙烷与巯基的开环反应、活性酯的酰胺化反应等。与共价药物反应类型相比,很多共价反应基团还未利用,具有很大发展空间。
总体来看,小分子、多肽共价RDC具有一定的优势。要获得稳定性好、对肿瘤特异性强的共价RDC仍有许多挑战,如何平衡肿瘤摄取高、血液快速清除、正常组织低蓄积仍是共价RDC药物设计中的难题。需要根据作用靶点的特点,合理设计共价RDC的反应基团类型、调节反应基团的空间位置(包括长度),提高共价RDC的自身稳定性、标记反应的稳定性等,从而获得肿瘤组织摄取高,其他组织蓄积低的实用共价RDC。
参考资料



