类弹性蛋白多肽 (ELP) 的发展历程、研究现状与未来前景
发布时间:
2025-10-15
作者:
刘文革博士,中晟全肽研发战略部执行总监
引言
类弹性蛋白多肽 (Elastin-like Polypeptides,ELPs) 是一类衍生于天然弹性蛋白的人工合成多肽聚合物,其分子结构以五肽重复序列 (VPGXG)ₙ为核心(X为除脯氨酸外的任意氨基酸)。ELP最显著的特征是温度响应性逆相转变 (Inverse Temperature Transition,ITT):当环境温度超过相转变温度 (Transition Temperature,Tt) 时,发生可逆相分离,形成不溶性凝聚相。通常可以通过调控五肽重复序列中“X”残基的种类、ELP分子量以及溶液环境,从而对Tt进行精准的工程化设计。
ELPs自20世纪90年代首次通过基因工程技术成功表达以来,凭借其可设计的ITT特性、优异的生物相容性、低免疫原性及精确可控的分子结构,在生物医学与材料科学领域引发广泛关注。尽管目前尚无基于ELP的药物或医疗器械通过监管机构批准上市,但部分候选药物已进入临床研究阶段,充分彰显其巨大应用潜力。本文将系统梳理ELPs三十余年(1990 年代至今)的发展脉络,重点回顾其在基因构建、理论建模及应用拓展中的关键里程碑;深入分析ELPs在智能药物递送、组织工程、医美及蛋白质纯化等领域的最新研究进展;并探讨其从实验室走向临床转化与商业化的现状及未来方向。
一、ELP的分子结构与来源
ELPs的设计灵感源于脊椎动物结缔组织中的弹性蛋白(Elastin),其可溶性前体为原弹性蛋白(tropoelastin)。人类、鸡、大鼠及牛的原弹性蛋白基因具有高度同源性,序列包含两大核心结构域:
1. 亲水性结构域:富含可发生交联反应的赖氨酸(Lys)与丙氨酸(Ala)残基,是弹性蛋白形成纤维网络的关键;
2. 疏水性结构域:以非极性残基(如缬氨酸Val、脯氨酸Pro、丙氨酸Ala、甘氨酸Gly)为主,常以四肽(Val-Pro-Gly-Gly)、五肽(Val-Pro-Gly-Val-Gly)或六肽重复序列形式存在——这些重复序列也是天然弹性蛋白具备弹性的基础。
尽管ELP源于原弹性蛋白的疏水性重复序列,但其与原弹性蛋白及成熟弹性蛋白在结构与功能上存在显著差异(表1):原弹性蛋白是可溶性单体,需经复杂生物交联才能形成不溶性成熟弹性蛋白(赋予组织弹性);而ELP是通过基因工程合成的“智能”生物聚合物,可通过序列设计实现温度响应等功能,无需交联即可发挥作用。最经典的ELP序列就是由疏水性重复序列五肽(Val-Pro-Gly-Xaa-Gly,VPGXG)串联重复构成。
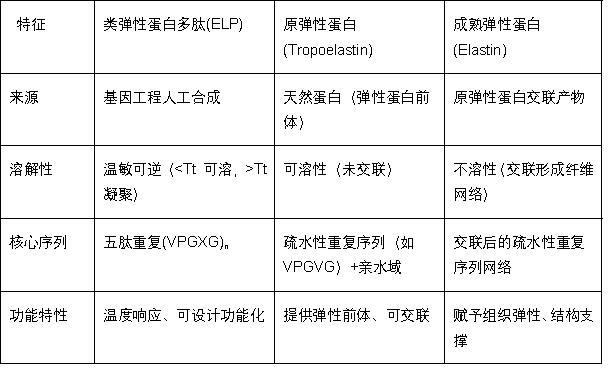
表1 类弹性蛋白多肽(ELP)、原弹性蛋白与成熟弹性蛋白的化学结构比较。
二、ELP的核心特性
ELPs的逆相转变行为与优良的生物学性能,共同支撑其在多领域的创新应用。
(一) 逆相转变行为(ITT)
这是ELPs最标志性的特征:在水溶液中,当温度低于Tt时,ELP分子链呈无规卷曲构象,可稳定溶解;当温度升至Tt以上时,多肽链快速发生构象重排,疏水基团暴露并伴随脱水,聚集形成不溶性凝聚相——这一过程随着温度的改变具有良好的可逆性(降温后可重新溶解)。
ELPs Tt的调控可通过以下关键参数实现,为应用场景定制提供灵活空间:
1. 客座残基疏水性:Xaa残基疏水性越强(如亮氨酸 Leu),Tt越低;
2. 分子量:ELP链越长(分子量越大),分子间疏水相互作用越强,Tt越低;
3. 溶液浓度:ELP浓度越高,分子碰撞概率增加,Tt越低;
4. 离子强度:溶液中盐(如 NaCl)浓度升高会增强疏水作用,降低Tt。
这种“温度触发”的智能响应特性,使ELPs成为构建靶向递送、缓释释放等响应性生物材料的理想模块 [1]。
(二) 生物学特性
ELPs的生物学优势使其在体内应用中脱颖而出,核心特性包括:
1. 生物相容性:作为蛋白质类材料,ELPs在体内不易引发炎症或免疫排斥反应;
2. 可生物降解性:可被体内蛋白酶降解为氨基酸,避免长期滞留体内的风险;
3. 低免疫原性:重复性序列与类天然蛋白结构使其免疫原性极低,降低体内应用的免疫风险;
4. 高度可设计性:通过基因工程可将功能性肽段、靶向配体或药物分子融合/偶联至ELP链,实现功能定制;
5. 相变后稳定性:相变凝聚形成的聚集体在体内具有超长稳定性,适用于长效药物储库;
6. 多场景适用性:可满足药物递送、融合蛋白构建、组织工程支架及医美成分等多样化需求。
三、发展历程:从基础研究到技术成熟的关键里程碑
ELPs的发展遵循“基础发现→技术突破→应用拓展”的路径,推动其从实验室走向工程化应用。
(一) 天然弹性蛋白的机制探索(1980 年代)
美国阿拉巴马大学的D.W.Urry团队是ELP研究的开创者,早期聚焦天然弹性蛋白的物理化学性质与分子机制,重点探索弹性蛋白的回弹力、疏水性及生物能量转换功能。基于对天然弹性蛋白重复序列(如VPGVG)的深入解析,Urry团队首次合成了含此类重复序列的多肽(“弹性蛋白的序列多肽”),并于1981年在《Journal of the American Chemical Society》发表研究,这一成果标志着人类首次实现对弹性蛋白功能的人工模拟,为ELP的诞生奠定基础。
(二) 首次重组表达与早期优化(1990 年代)
在天然弹性蛋白研究的基础上,Urry团队于 1992 年报道通过重组DNA技术在大肠杆菌(E. coli)中表达并生产ELPs[2],突破了化学合成难以制备高分子量、序列均一ELP的局限。1995-1996 年,该团队进一步优化基因合成与超表达系统,实现了更高分子量ELP的制备,并系统阐述了ELP的遗传工程构建方法。这一阶段的研究重点集中于ELP的热响应机制与基础物理化学性质,为后续应用探索提供了材料基础。
(三) 基因工程技术的革命性突破(2002 年)
2002年,美国杜克大学的Ashutosh Chilkoti团队报道了通过递归定向连接(Recursive Directional Ligation,RDL)技术[3] 将编码ELP单体的短基因片段逐步拼接,最终可精确构建出编码“特定重复次数、特定序列、特定分子量”ELP的基因,成为ELP领域的核心技术突破。这一技术彻底简化了ELP基因库的构建流程,实现了ELP结构与功能的精准匹配——研究人员可根据应用需求“量体裁衣”设计ELP,极大推动了ELP结构-功能关系的系统研究。
(四) 理论建模深化与应用拓展(2000 年代中后期-2010 年代)
随着RDL技术的成熟,研究重心也从“合成方法”转向“理论建模”与“应用开发”:
1. 理论层面:建立了精准的数学模型,可预测不同序列、分子量的ELP及其融合蛋白的Tt,大幅加速新型ELP材料的设计效率;
2. 应用层面:ELP的应用场景从生物材料拓展至药物递送、组织工程、生物分离等领域。例如,2013年研究报道将胰高血糖素样肽-1(GLP-1)与ELP融合,构建长效缓释递送系统,为糖尿病等慢性病治疗提供了新方案 [4]。
(五) 前沿探索与临床转化推进(2020-2025 年)
进入2020年代,ELP研究聚焦“技术优化”“复杂问题解决”与“临床转化”三大方向:
1. 技术优化:2024年有研究报道通过对RDL技术的改进,解决了高拷贝数质粒中ELP基因构建的效率问题 [5];另有研究探索ELP的热响应性调控大肠杆菌内蛋白质转运,为合成生物学提供新工具;
2. 应用突破:在药物递送领域,针对小核酸药物“内体逃逸”瓶颈,开发了基于ELP的ENTER纳米颗粒平台——通过在ELP中嵌入组氨酸与内涵体逃逸肽(EEP),实现了蛋白质、siRNA、mRNA及基因编辑工具的高效胞质递送,且在小鼠肺部基因编辑中验证了有效性 [6];
3. 临床推进:部分ELP候选药物进入早期临床试验,为后续转化奠定基础。
四、ELP在生物医学领域的应用
凭借“智能响应 + 优良生物性能”的组合优势,ELPs在生物医学领域展现出多元化应用潜力,以下为核心领域的最新进展。
(一) 药物递送:ELP最活跃的应用领域
ELP可通过温度响应、自组装等特性,实现药物的靶向递送、长效缓释与安全给药,关键成果包括:
1. 延长药物半衰期
将半衰期短的蛋白/多肽药物(如 GLP-1、胰岛素)与ELP融合,可显著增加药物的流体动力学体积,减缓肾脏清除速率,延长体内作用时间。例如,PhaseBio公司的PB1023(ELP-GLP-1 融合蛋白)通过这一机制实现每周一次给药,目前处于II期临床试验阶段(用于II型糖尿病治疗)。
2. 肿瘤局部靶向递送(ELP-BT技术)
利用实体瘤区域温度略高于正常组织(或外部物理加热)的特点,设计Tt为10-25℃的温敏ELP:通过放射同位素标记ELP,构建可注射“放射性种子”(ELP brachytherapy,ELP-BT);肿瘤内注射后,ELP 因体温(37℃>Tt)触发相变凝集,形成可生物降解的放射性聚集体——无需手术植入/取出,规避了传统金属I-125粒子的侵入性风险,为肿瘤近距离放射治疗提供新方案。
3. 抗肿瘤药物的系统递送
ELP可自组装形成尺寸<100nm的单分散纳米颗粒,用于包裹疏水性化疗药物(如阿霉素),提升药物溶解度与生物利用度。这类纳米颗粒由ELP链与富含半胱氨酸(Cys)的短片段连接形成嵌合多肽(CPs),通过Cys残基共价修饰疏水性药物后自发组装。在小鼠癌症模型中,该系统的最大耐受剂量是游离药物的4倍,单次给药可诱导肿瘤几乎完全消退,为多功能纳米药物(药物+显像剂+靶向配体)的构建提供简易策略。
4. 小核酸药物的高效递送(ENTER 平台)
针对小核酸药物(siRNA、mRNA)递送中“内体逃逸难”的核心问题,ENTER平台(Elastin-based Nanoparticles for Therapeutic Delivery)的设计极具创新性:
1)机制:在ELP中嵌入组氨酸与内涵体逃逸肽(EEP)——内体酸化时,组氨酸像“质子海绵”吸收质子,引发内体膨胀;pH降至临界点后,ELP结构解体,暴露EEP帮助药物逃离内体;
2)效果:在体外实现多种细胞(包括原代细胞)的高效低毒递送,在体内成功完成小鼠肺部Cre重组酶mRNA/蛋白递送,且对大/小气道上皮细胞(纤毛细胞、杯状细胞等)均有转染效果 [6](图1)。
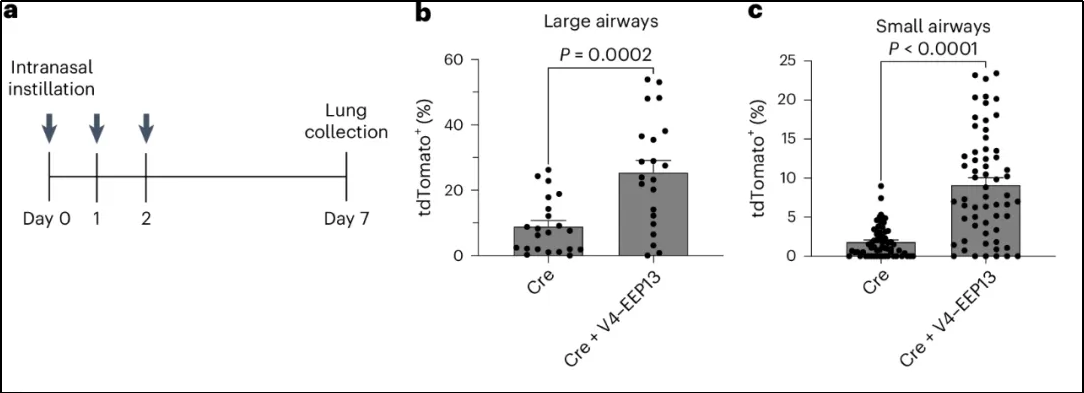
图1 增强版ENTER平台的小鼠肺部递送效果,a.实验设计:通过鼻滴方式给予Cre mRNA/蛋白(单独或与ENTER纳米颗粒共递送);b-c.荧光成像结果:与单独Cre组相比,ENTER共递组的tdTomato阳性细胞比例显著升高(P<0.0001),表明基因编辑效率提升。
(二) 组织工程与再生医学
ELP的生物相容性、可降解性及刺激响应性,使其成为组织工程支架的理想材料,核心应用包括:
1. 伤口修复与敷料
类人胶原蛋白(hCol)是伤口愈合的关键成分,但天然hCol敷料在体内稳定性差。研究人员开发了hCol-ELP重组融合蛋白:既保留hCol的生物活性,又因ELP的引入形成紧密均匀的层状结构,稳定性显著提升。在小鼠皮肤伤口模型中,hCol-ELP可减轻炎症反应、促进胶原蛋白再生,加速伤口愈合并减少瘢痕形成 [7](图2)。
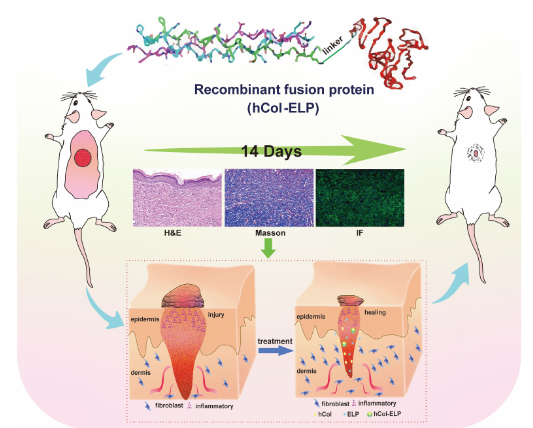
图2 hCol-ELP融合蛋白的伤口愈合效果
此外,ELP可设计为“室温液体-体温凝胶”的可注射水凝胶:微创注射至伤口部位后,因体温触发相变形成凝胶,为细胞生长提供支架,同时可持续释放抗菌药物或生长因子(如EGF),进一步促进愈合。
2. 软骨与血管组织工程
1) 软骨修复:ELP材料可模拟软骨细胞外基质的物理特性(如弹性、多孔结构),为软骨细胞提供适宜的生长微环境。研究表明,ELP支架可支持软骨细胞的增殖与分化,促进Ⅱ型胶原蛋白的表达,为软骨损伤修复提供新载体;
2) 人工血管支架:ELP的可降解性与力学可调性使其在人工血管构建中显示潜力,但目前支架的机械强度(如抗张强度、弹性模量)与降解速率的匹配性仍需优化,以满足血管组织的长期功能需求。
3. 蛋白质纯化:低成本高效分离技术
利用ELP的逆相转变特性(ITT),可实现重组蛋白的“绿色纯化”:将目标蛋白与ELP融合表达后,通过以下步骤分离:
1) 破碎细胞获得裂解液,升温至Tt以上,ELP-目标蛋白融合体聚集沉淀;
2) 离心收集沉淀,降温至Tt以下重新溶解;
3) 重复1-2次即可获得高纯度目标蛋白。
该方法无需昂贵的亲和层析介质,避免了传统纯化的高成本与污染风险,纯度可达95%以上,回收率超80%[8]——已广泛应用于酶、抗体片段等重组蛋白的规模化纯化。
(三) 医美领域:安全高效的抗衰老成分
天然弹性蛋白因分子量过大(>700个氨基酸)无法经皮肤吸收,而工程改造的小分子ELPs可突破这一局限,成为医美领域的新型活性成分:
1. 皮肤抗衰老
ELP的活性序列(如VGVAPG)可穿透皮肤表层,激活成纤维细胞,促进弹性蛋白与胶原蛋白的合成,从而改善皮肤松弛、减少细纹。2022 年研究表明,含ELP的护肤品可显著提升老年小鼠皮肤的弹性模量与含水量,且无皮肤刺激反应 [9]。
2. 软组织填充
ELP与海藻酸盐复合可形成“温敏水凝胶”:注射时为液体,进入体内后因体温触发相变形成三维网络结构,提供即时支撑力,适用于鼻唇沟、太阳穴等部位的凹陷填充。该水凝胶的弹性模量(≈10-20kPa)接近天然皮肤组织,填充后触感自然,且可生物降解,避免了传统合成填充剂的长期滞留风险 [10]。
(四) 临床转化与商业化现状
目前ELP的临床转化仍处于早期阶段:全球范围内尚无基于ELP的治疗药物或医疗器械完成III期临床试验,但已有少数候选药物进入临床研究,验证了其安全性与可行性,不过规模化生产的成本控制、长期体内安全性数据的积累、监管审批路径的明确化,仍是ELP临床转化的核心障碍。
五、未来展望与总结
自1990年代首次重组表达以来,ELPs已从新型生物聚合物发展为“理论扎实、技术成熟、应用广泛”的智能生物材料平台 ,这离不开推动领域发展的两大关键里程碑:重组表达技术的突破与RDL基因构建方法的发明。展望未来,ELP领域将聚焦以下方向:
(一) 设计精细化与功能集成化
未来ELP的设计将更注重“多重响应性”与“多功能协同”:例如,开发“温度-pH-酶”三重响应的ELP,实现肿瘤微环境(弱酸、高酶活性)的精准靶向;或集成“靶向递送-疗效监测-副作用缓解”功能,提升药物治疗的精准度与安全性。
(二) 突破生物学递送障碍
针对ELP药物递送系统,未来研究将重点解决三大问题:
1. 循环稳定性:通过PEG修饰或构建纳米颗粒,减少ELP在体内的清除与降解;
2. 靶向效率:引入主动靶向配体(如抗体、肽段),提升对病灶组织(如肿瘤、炎症部位)的特异性结合;
3. 生物屏障穿透:探索ELP穿透血脑屏障、肿瘤间质屏障的策略,为中枢神经系统疾病、实体瘤的治疗提供新路径。
(三) 生产工艺规模化与低成本化
ELP的产业化依赖于生产工艺的优化:
1. 表达系统:开发高产率的重组体系(如优化大肠杆菌、酵母或哺乳动物细胞表达),提升ELP的发酵效率;
2. 纯化工艺:改进基于ITT的纯化技术,或结合膜分离、色谱技术,降低下游纯化成本——这是ELP产品走向商业化的关键。
(四) 加速临床转化与监管协作
随着更多ELP候选药物进入临床试验,未来需要:
1. 积累长期体内安全性数据(如免疫原性、器官毒性);
2. 与监管机构(如FDA、NMPA)协作,明确ELP类产品的审批标准(如质量控制、临床评价指标),推动技术快速落地。
总结
ELP凭借其独特的温敏逆相转变特性及优异的生物学性能(生物相容性、可降解性、低免疫原性等),在精准药物递送(尤其小核酸、放射核素药物)、组织工程及医美领域已展现出不可替代的价值。尽管目前临床研究最远仅推进至II期,但随着技术优化与转化研究的深入,基于ELP的创新产品有望在未来5-10年内逐步进入市场,为生物医学领域带来新的突破。
参考资料
[1] MacEwan S R, Chilkoti A. Elastin-like polypeptides: biomedical applications of tunable biopolymers[J]. Biopolymers, 2010, 94(1): 60-77.
[2] McPherson D T, et al. Production and purification of a recombinant elastomeric polypeptide, G-(VPGVG)19-VPGV, from Escherichia coli[J]. Biotechnology Progress, 1992, 8(4): 347-352.
[3] Meyer D E, Chilkoti A. Genetically encoded synthesis of protein-based polymers with precisely specified molecular weight and sequence by recursive directional ligation: examples from the elastin-like polypeptide system[J]. Biomacromolecules, 2002, 3(2): 357-367.
[4] Amiram M, et al. Injectable protease-operated depots of glucagon-like peptide-1 provide extended and tunable glucose control[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(8): 2792-2797.
[5] Nelson D W, et al. Construction of an Elastin-like Polypeptide Gene in a High Copy Number Plasmid Using a Modified Method of Recursive Directional Ligation[J]. MDPI, 2024.
[6] Eweje F, et al. Self-assembling protein nanoparticles for cytosolic delivery of nucleic acids and proteins[J]. Nature Biotechnology, 2025.
[7] Chen Y, et al. Construction of a Collagen-like Protein Based on Elastin-like Polypeptide Fusion and Evaluation of Its Performance in Promoting Wound Healing[J]. Molecules, 2023, 28(19).
[8] Hassouneh W, Christensen T, Chilkoti A. Elastin-like polypeptides as a purification tag for recombinant proteins[J]. Current Protocols in Protein Science, 2010, Chapter 6: 6.11.1-6.11.16.
[9] Wu K, et al. An artificially designed elastin-like recombinant polypeptide improves aging skin[J]. American Journal of Translational Research, 2022, 14(12): 8562-8571.
[10] 郭钟伟,孙伟。类弹性蛋白多肽 - 海藻酸盐复合水凝胶及其制备方法与应用 [P]. 2023.



