减肥增肌靶标及药物研发进展
发布时间:
2025-04-02
作者:
戴秋云 博士,中晟全肽研发战略部副总级顾问
引言
在减肥药领域,GLP-1受体激动剂及其多靶点药物无疑是佼佼者,司马格鲁肽减肥药已家喻户晓。由于GLP-1类减肥药存在肠胃副作用(恶心、腹泻等)、停药体重迅速反弹及减肥又减肌的缺点,减肥增肌或减肥不减肌的迭代药物迅速兴起,多个药物进入I-III期临床试验,成为减肥药必争的第二战场。本文介绍减肥增肌靶点及药物研发最新进展,供从事减肥药研发领域人员参考。
目前GLP-1受体激动剂司马格鲁肽减肥药已得到快速推广,产品研发公司诺和诺德赚得盆丰钵满。2024年司美格鲁肽合计收入达到惊人的292.96亿美元(Ozempic,174.66;Rybelsus,33.82;Wegovy,84.48)(诺和诺德年报),仅与全球药物销售冠军K药销售收入差距不到2亿美元(294.82亿美元),司马格鲁肽的收入中除用于糖尿病降糖外,主要是用于减肥。目前,国内外药企围绕GLP-1受体(GLP-1R)及其多靶点,开展了迭代药物研发,以期增加药效、使用适应性或降低副作用。另一方面,针对GLP-1类减肥药的缺点,如恶心、腹泻副作用(导致约50%患者停药)、停药后体重迅速反弹(超过60%患者在停药后1年内体重反弹)、减去的体重含15-60%为肌肉(Alnylam2025研发报告)等,正在开辟减肥药第二战场—减肥增肌或减肥不减肌药物研发,且已取得显著进展[1],多个药物进入I-III期临床试验。本文简要介绍GLP-1R类迭代药物新进展,着重介绍减肥增肌新靶标及其药物研发进展,为从事减肥药研发人员提供参考。
1、GLP-1R及多靶点药物的持续升级
目前有十多个减肥药处于临床III期试验,其中GLP-1或多靶点占多数,如胰高血糖素样肽-1(GLP-1)受体激动剂(RA)(Ecnoglutide,Orforglipron和TG103)、GLP-1 RA/胰淀素激动剂(CagriSema)、GLP-1/胰高血糖素RA(Mazdutede和Survodutide)、GLP-1/葡萄糖依赖性促胰岛素多肽/胰高血糖素RA(Retatrutide)等。已完成II期临床减肥药的减肥效果见图1[2]。一些多肽或小分子的结构见图2。从减肥幅度来看,GLP-1/GIP/Glucagon三靶点药物retatrutide的减重幅度最大(24.2%)。除Retartrutide外,今后几年新一代的GLP-1R激动剂或多靶点激动剂Orforglipron、CagriSema、CT-388等,以其使用方便性或低副作用等优势而得到发展。
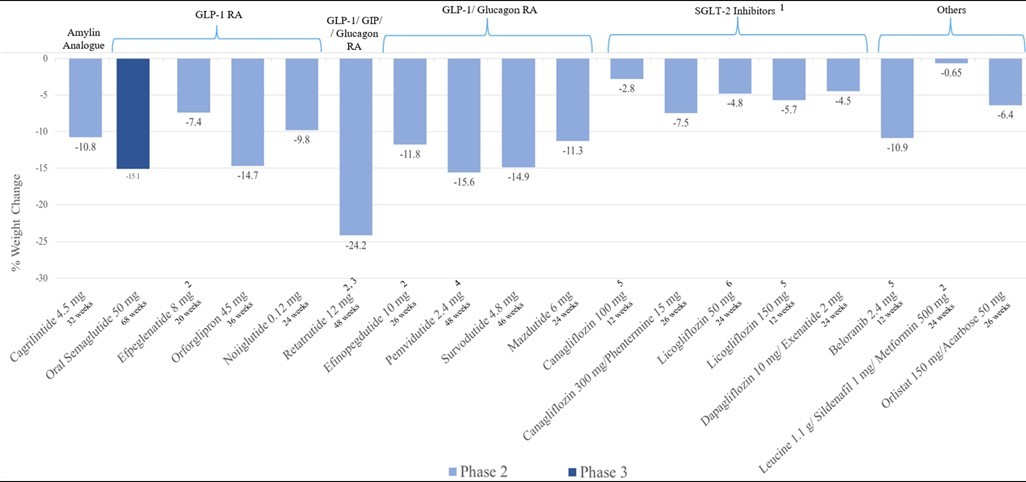
图 1. GLP-1R及其多靶点药物的减重效果[2]
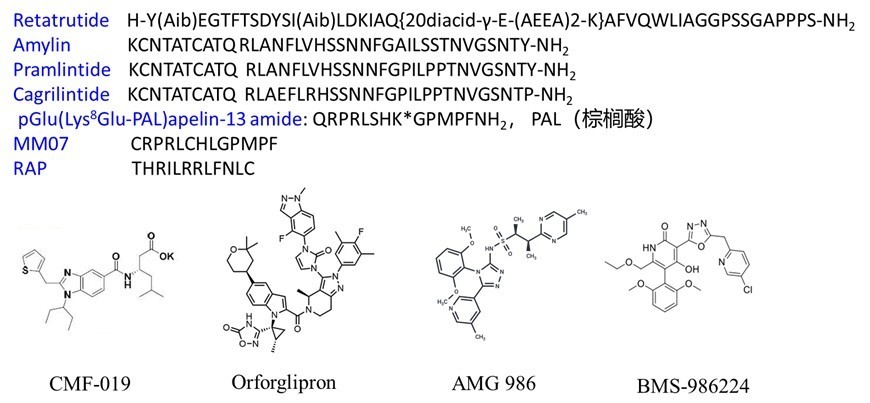
图2. 部分GLP-1R及多靶点激动剂、减肥增肌分子的氨基酸序列或结构
Orforglipron(LY3502970)是由礼来开发的口服GLP-1受体激动剂,一日一次。该小分子能够刺激GLP-1R诱导的cAMP积累,未检测到GLP-1R介导的β-arrestin蛋白的募集作用。II期临床试验结果显示[3],在第26周时,Orforglipron剂量组(12, 24, 36,或45 mg)的体重与基线相比的平均变化范围为-8.6%至-12.6%,安慰剂组为-2.0%。在第36周,Orforglipron的平均变化范围为-9.4%至-14.7%,显示显著的减重效果。目前Orforglipron已经进入III期临床试验阶段,预计2026年上市。该药的上市将冲击注射型司马格鲁肽及替尔泊肽的市场份额。
CT-388原由Carmot Therapeutics公司开发,属于GLP-1/GIP受体双重调节剂,可以一周一次注射给药。2023年12月罗氏收购Carmot Therapeutics公司,继续进行开发。I期临床试验显示,健康肥胖成人每周皮下注射一次CT-388,24周后,平均体重可减少18.8%。该肽对β-arrestin的作用弱,可减少药物对心肌方面的副作用,目前正处于II期临床试验阶段(Roche官网)。
2、处于临床研究中的减肥增肌靶点及药物
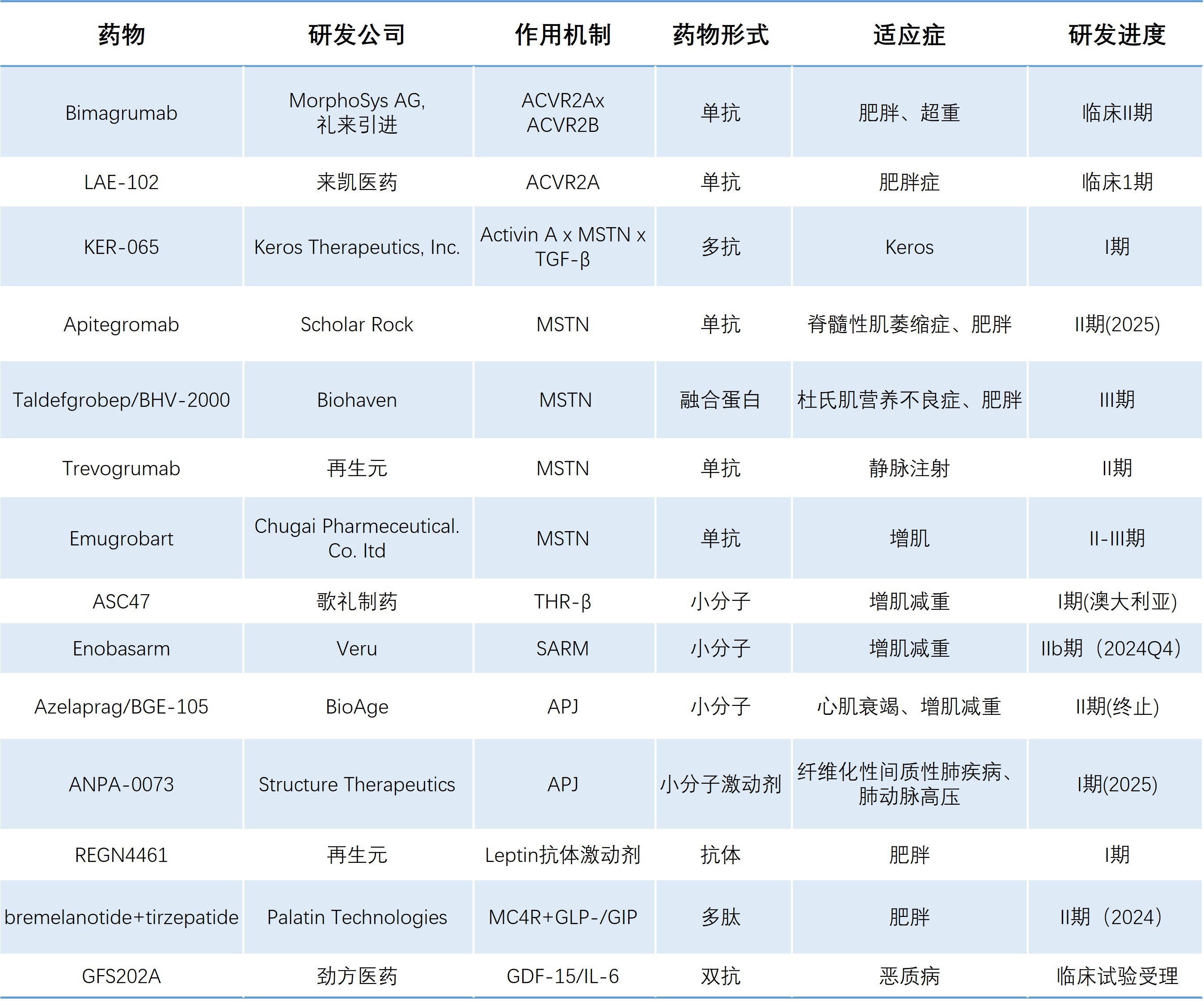
目前发现激活素受体ACVR、肌肉生长抑素MSTN、Apelin受体APJ、甲状腺激素受体β(THR-β)、选择性雄性激素受体(SARM)调节剂、瘦素leptin、黑色素受体MC4R、GDF-15、Gherin受体等具有发展减肥增肌或减肥不减肌药潜力,一些重要的单靶药物或与GLP-1激动剂多靶点药物或联合用药已进入I-III期临床试验(表1)。下面对几个重要的靶点及药物研发进展进行简要介绍。
表1. 进入临床试验的减肥增肌靶点及药物
2.1 激活素受体ActR拮抗剂
激活素受体ActR2包括激活素受体ACVR2A及ACVR2B,是转化生长因子β(TGF-β)受体超家族中的两个重要成员,其在细胞生长、分化和组织修复等多种生理过程中发挥关键作用[4]。肌肉生长和发育是一个复杂的过程,受到多种因素的调控,其中ACVR2A和ACVR2B作为关键受体,扮演着重要角色。研究表明,抑制这两种受体可以促进肌肉生长并防止肌肉萎缩,这种双重作用使其成为治疗肥胖和相关代谢疾病有吸引力的靶点。目前,ACVR2A及ACVR2B融合蛋白用于治疗肺动脉高压、地中海贫血、骨髓增生异常综合征抑郁症等,如默沙东Sotatercept、BMS的Luspatercept已上市,一些也进入临床II-III期[5]。近期发现,靶向该受体的抗体药物具有显著的减重增肌活性。靶向ActR2A/B单抗Bimagrumab(礼来研发)的II期试验(NCT03005288)结果显示,75名体重指数介于28和40之间的2型糖尿病患者在48周内接受了bimagrumab治疗后,脂肪减少超过20.5%,而安慰剂组体重仅减少0.5%。除促进脂肪减少外,受试者瘦体重增加了3.6%,而安慰剂组瘦体重降低了0.8%[6]。此外,Alnylam、Arrowhead Pharmaceuticals等开展了Activin E、ActRIc(ALK7)的siRNA单药及与GLP-1联合用药用于减肥增肌的临床前研究(数据来源于公司网站),具有减肥不减肌活性。
国内来凯医药的对ActRIIA的单克隆抗体LAE102,与GLP-1受体激动剂联用可进一步减少脂肪,并显著降低GLP-1受体激动剂导致的肌肉流失。2024年6月,LAE102已开始临床I期试验。该公司的LAE-103(靶标ACVR2B)、LAE-123(靶标ACVR2AxACVR2B)也正在积极推进中。此外,宜明昂科的IMC-003(靶标ACVR2A)及一个双靶抗体(IMC-004)也在研发中。
2.2 肌肉生长抑制素(MSTN)拮抗剂
肌肉生长抑制素(MSTN)(也称生长分化因子8(GDF8))也属TGF-β家族成员,在骨骼肌中广泛表达,基因突变或敲除MSTN会导致肌肉质量显著增加。该靶点在肌肉萎缩症和肌肉衰减综合征等疾病治疗中具有显著疗效[7]。Trevogrumab是再生元开发的一款MSTN单抗,目前正在联合garetosmab(抗激活素A单抗)针对肥胖适应症开展临床Ⅱ期研究。2024年11月,再生元披露了Trevogrumab联合garetosmab的Ⅰ期临床结果。在单剂量研究中,设置了Trevogrumab (6 mg/kg, N=6)、garetosmab (10 mg/kg,N=6),Trevogrumab (6mg/kg)联合garetosmab(1 mg/kg、3 mg/kg、10 mg/kg)或安慰剂(N=12)组。结果显示,Trevogrumab(6 mg/kg)联合garetosmab(10 mg/kg)给药8周后,女性大腿肌肉体积较基线增加7.7%,而总脂肪量和腹部脂肪量较基线出现下降(-4.6%和-6.7%),显示联用疗法具有显著的减脂增肌效果。
Apitegromab 由Scholar Rock研发,其选择性地靶向MSLN的前体或非活性形式,阻断其在肌肉中的激活,主要适应症为脊髓性肌萎缩症。Apitegromab 的III期临床研究达到了主要终点,显著改善了患者的运动功能[8]。今年1月Scholar Rock已向美国FDA提交了Apitegromab上市申请。2024年5月,Apitegromab与GLP-1R药物(semaglutide或tirzepatide)联合使用治疗肥胖症的II期临床试验申请也获得FDA批准(来自Scholar Rock公司网站)。
2.3 甲状腺激素受体β(THR-β)激动剂
甲状腺激素受体β(THR-β)通过甲状腺激素的多种代谢作用对肝脏稳态起着至关重要的作用,其激动剂可以改善脂质代谢。针对该靶点的ASC47(歌礼制药)已在澳大利亚完成Ib临床试验。结果显示,ASC47在LDL-C偏高的健康受试者(10毫克、30毫克、90毫克)和肥胖症患者(90 毫克)中单次皮下注射后,经安慰剂校准的LDL-C降幅为22%,总胆固醇(TC)降幅为16%。在与司美格鲁肽治疗的DIO小鼠比较试验中,低剂量ASC47联合司美格鲁肽显示显著减重增肌效果(表2),单剂量ASC47(9 mg/kg)的减重幅度不大(1.55%),但低剂量ASC47(3 mg/kg或9 mg/kg)联合司美格鲁肽(30 nmol/kg,皮下注射,每日一次)用药使体重下降36%,显著高于司美格鲁肽单药疗法(体重下降23%),且肌肉总量/总体重显著提高。
表2. ASC47联合司美格鲁肽对小鼠减重增肌数据

2.4 APJ受体激动剂
Apelin受体(APJ)属于孤儿G蛋白偶联受体,Apelin及其受体在多种器官和组织中表达,包括中枢神经系统、心脏、肺、脂肪组织和胃肠道等[9]。APJ的内源性配体包括Apelin和Elabela两类多肽。Apelin对APJ受体的激活触发细胞内G蛋白依赖性信号传导途径,增加心肌收缩性和血管舒张,而机械拉伸激活APJ介导的β-arrestin信号传导,导致心脏肥大。因此,G蛋白偏向的APJ激动剂可以用于心力衰竭的治疗。此外,APJ介导的β-arrestin信号传导的丧失可以缓解饮食诱导的代谢功能障碍等。
BioAge(AMG占股)开发的Azelaprag(AMG986)激动剂,可预防肌肉萎缩。2024年6月启动了与替尔泊肽联用治疗肥胖的临床II期试验,最近的结果显示患者出现转氨酶升高副作用,而单独的替尔泊肽无类似副作用,目前已终止临床试验。类似的激动剂还有BMS公司的BMS-986224[10]。总的来说,目前的APJ激动剂偏向性不高。最近APJ激动剂与APJ受体复合物结构被解析[10],发现了完全偏向的激动剂,但活性仅为100 nM [11]。
2.5 瘦素、黑色素受体MC4R等其他激动剂
瘦素单药减重效果不显著,但与pramlintide的联合使用后,可使超重者的体重减轻更多。再生元的瘦素单抗激动剂REGN4461,在全身性脂肪营养不良的小鼠模型中,REGN4461缓解了高食欲、高血糖、胰岛素抵抗、血脂异常和肝脂肪变性。I期临床结果显示,用REGN4461治疗超重或肥胖的人,在循环瘦素浓度低(<8 ng/ml)的人中,体重在12周内有所下降,但对基线瘦素水平较高的人的体重没有影响[12]。最近诺和诺德公司开展了GLP-1R/LepR双重激动剂研发,该多肽在leptin缺乏的肥胖小鼠模型中表现出显著的减少进食量和降低体重的效果(图3)[13]。

图3. GLP-1R/LepR双重激动剂的小鼠减重效果[13]
MC4R是公认的治疗肥胖的靶点,但目前还缺乏高选择性和安全的MC4R激动剂[14,15]。Palatin Technologies公司将上市的MC4R bremelanotide与替尔泊肽联合使用,小鼠试验显示,MC4R激动剂可增强GLP-1激动剂利拉鲁肽的药效[16], 2024年已开展II期临床试验。
3、减肥增肌潜在新靶点
笔者认为一些潜在的新靶点,如受体蛋白酪氨酸激酶Mer (MERTK)、GPR75、Irisin、Dysferlin、ANGPTL8、脂肪酸受体4(Ffar4)以及一些新发现多肽、蛋白质还未找到确切受体的靶点(表3)可能在减肥增肌中发挥作用[17-26]。BRP是最近发现的一种全新、非胰岛素促分泌素类的抗肥胖多肽,在小鼠和小型猪模型中,BRP单次给药即可显著降低食物摄入量,效果持续数小时。此外,BRP不会引起低血糖或恶心等GLP-1药物常见的不良反应,且减脂不减肌(图4)。其作用机制与GLP-1等不同,主要通过激活大脑下丘脑区域特定神经元中的cAMP-PKA-CREB-FOS信号通路来抑制食欲[18]。
表3. 一些潜在的减肥增肌新靶点
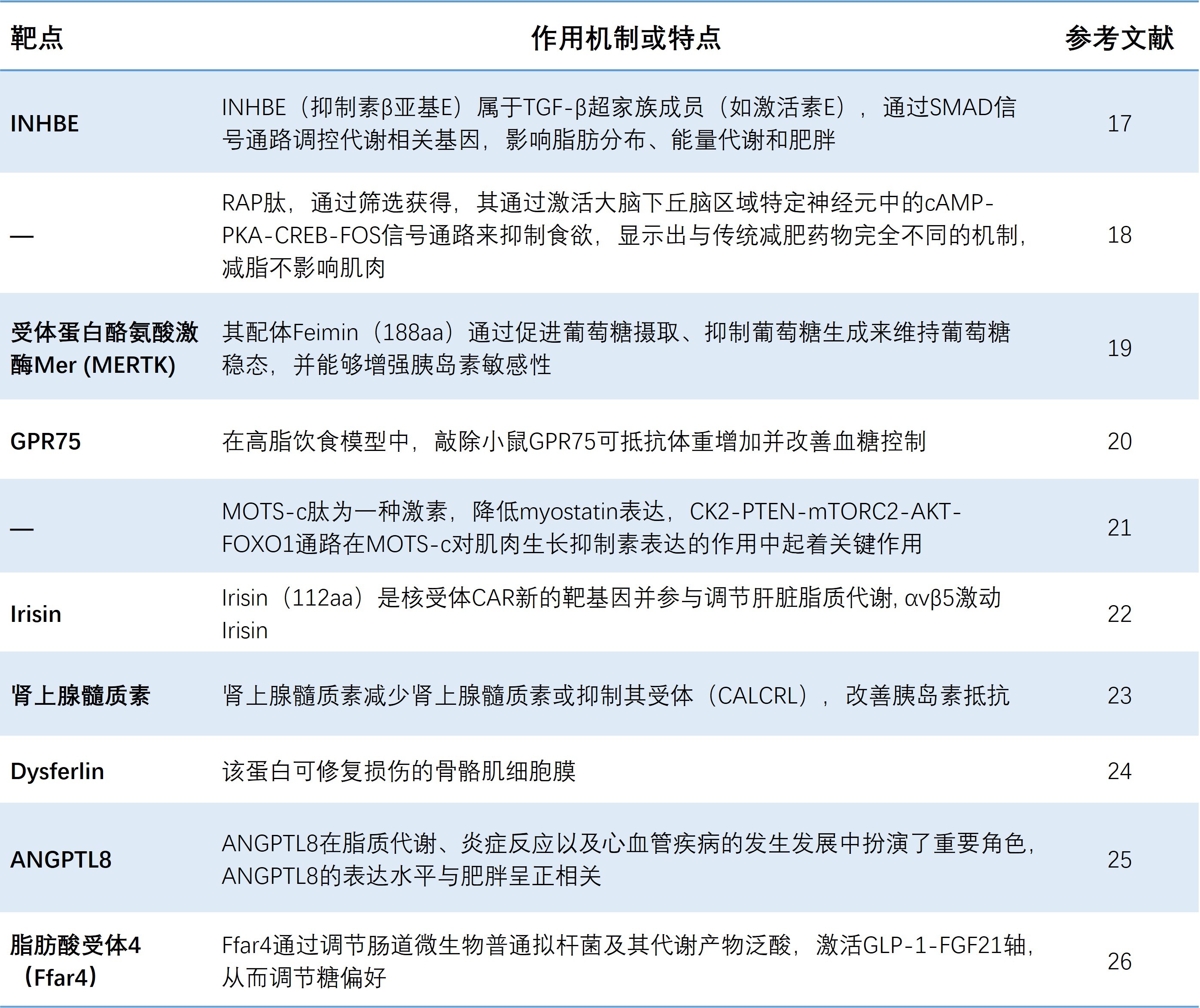
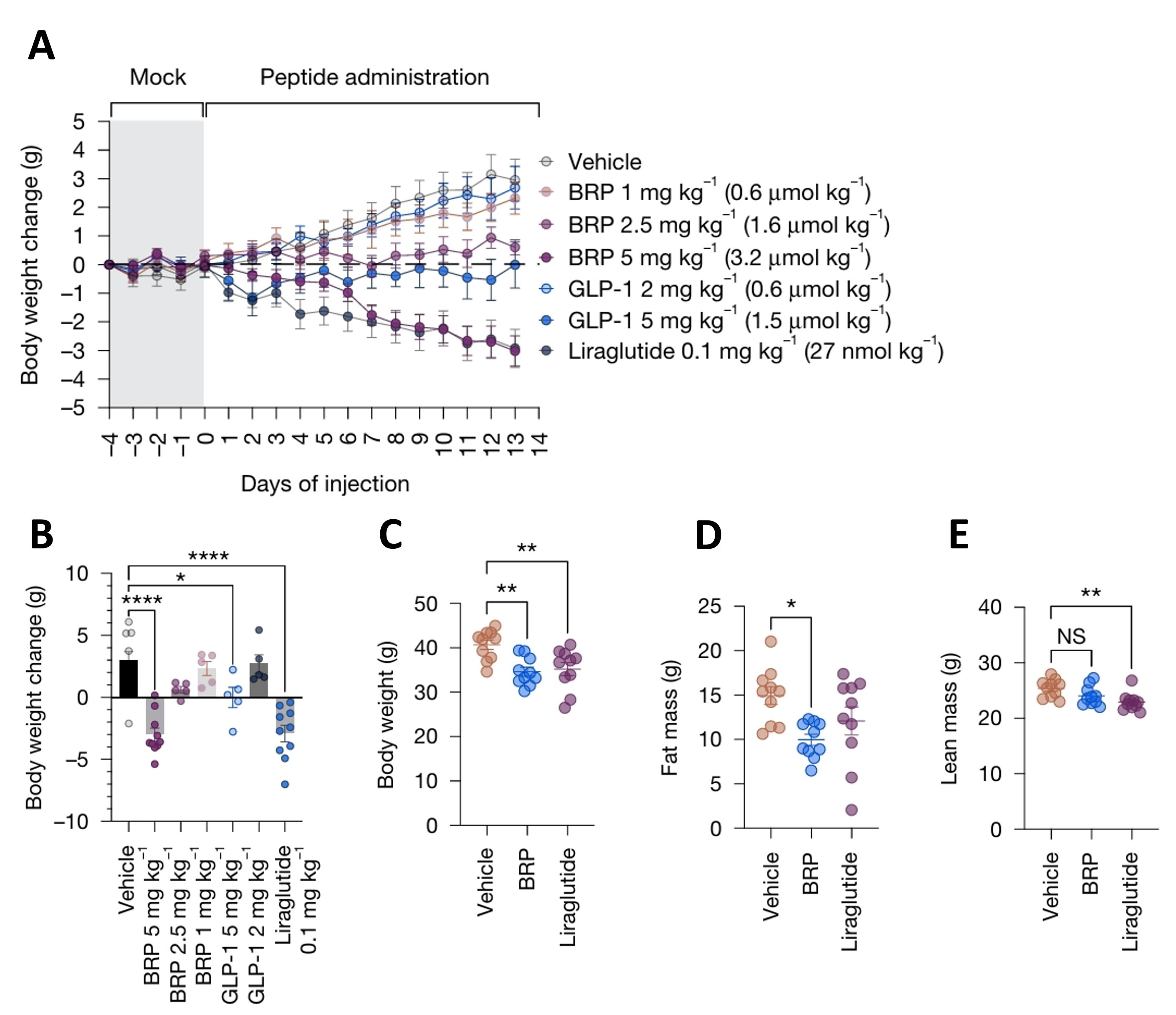
图4. RAP肽具有减肥不减肌活性[18]
4、总结
目前已发现的减肥增肌靶点不少,但单独用药减肥效果不及GLP-1R激动剂及其多靶药激动剂,联合用药后的效果高于GLP-1R激动剂或具有显著的减肥增肌效果。一些原来只用于肿瘤患者恶质病的肌肉增强剂,与GLP-1R激动剂联合用药后,获得减肥增肌效果。
从进展来看,一些改进型的GLP-1R单靶点及多靶点激动剂将率先获得批准,如GLP-1/葡萄糖依赖性促胰岛素多肽和胰高血糖素受体激动剂(Retatrutide)、口服的GLP-1R小分子体激动剂(Orforglipron)等。新的GLP-1迭代产品预期在减少副作用、减少停药后体重反弹、使用方便方面发挥作用。在减肥增肌方面,激活素受体ACVRII、肌肉生长抑素MSTN抗体类拮抗剂可能跟进获批,靶向Apelin受体APJ、选甲状腺激素受体β、瘦素leptin、黑色素受体MC4R分子还需更多的临床试验,验证其减肥增肌或不减肌效果。
近期出现的新靶点可能在减肥增肌中发挥作用,显示诱人的发展潜力,但需进一步的动物实验及临床研究证实其效果。
参考文献
- 1.Dolgin E. Dozens of new obesity drugs are coming: these are the ones to watch. Nature. 2025 Feb;638(8050):308-310. doi: 10.1038/d41586-025-00404-9.
- 2.Kokkorakis M, Chakhtoura M, Rhayem C, et al. Emerging pharmacotherapies for obesity: A systematic review. Pharmacol Rev. 2025, 77(1):100002.
- 3.Wharton S, Blevins T, Connery L, et al. Daily Oral GLP-1 Receptor Agonist Orforglipron for Adults with Obesity. N Engl J Med. 2023, 389(10):877-888.
- 4.Morvan F, Rondeau JM, Zou C, et al. Blockade of activin type II receptors with a dual anti-ActRIIA/IIB antibody is critical to promote maximal skeletal muscle hypertrophy. Proc Natl Acad Sci U S A. 2017, 114(47):12448-12453.
- 5.Nunn E, Jaiswal N, Gavin M, et al. Antibody blockade of activin type II receptors preserves skeletal muscle mass and enhances fat loss during GLP-1 receptor agonism. Mol Metab. 2024, 101880.
- 6.Heymsfield SB, Coleman LA, Miller R, et al. Effect of Bimagrumab vs Placebo on Body Fat Mass Among Adults With Type 2 Diabetes and Obesity: A Phase 2 Randomized Clinical Trial. JAMA Netw Open. 2021, 4(1):e2033457.
- 7.Stefanakis K, Kokkorakis M, Mantzoros CS. The impact of weight loss on fat-free mass, muscle, bone and hematopoiesis health: Implications for emerging pharmacotherapies aiming at fat reduction and lean mass preservation. Metabolism. 2024, 161:156057.
- 8.Crawford TO, Darras BT, Day JW, et al. Safety and Efficacy of Apitegromab in Patients With Spinal Muscular Atrophy Types 2 and 3: The Phase 2 TOPAZ Study. Neurology. 2024, 102(5):e209151.
- 9.Hu G, Wang Z, Zhang R, et al. The Role of Apelin/Apelin Receptor in Energy Metabolism and Water Homeostasis: A Comprehensive Narrative Review. Front Physiol. 2021, 12:632886.
- 10.Gargalovic P, Wong P, Onorato J, et al. In Vitro and In Vivo Evaluation of a Small-Molecule APJ (Apelin Receptor) Agonist, BMS-986224, as a Potential Treatment for Heart Failure. Circ Heart Fail. 2021, 14(3):e007351.
- 11.Wang WW, Ji SY, Zhang W, et al. Structure-based design of non-hypertrophic apelin receptor modulator. Cell. 2024, 187(6):1460-1475.e20.
- 12.Altarejos JY, Pangilinan J, Podgrabinska S,et al. Preclinical, randomized phase 1, and compassionate use evaluation of REGN4461, a leptin receptor agonist antibody for leptin deficiency. Sci Transl Med. 2023, 15(723):eadd4897.
- 13. Polex-Wolf J, Deibler K, Hogendorf WFJ, et al. Glp1r-Lepr coexpressing neurons modulate the suppression of food intake and body weight by a GLP-1/leptin dual agonist. Sci Transl Med. 2024, 16(776):eadk4908.
- 14.Müller TD, Blüher M, Tschöp MH, DiMarchi RD. Anti-obesity drug discovery: advances and challenges. Nat Rev Drug Discov. 2022, 21(3):201-223.]
- 15.Liu Z, Hruby VJ. MC4R biased signalling and the conformational basis of biological function selections. J Cell Mol Med. 2022, 26(15):4125-4136.
- 16.Dahir NS, Gui Y, Wu Y, et al. Subthreshold activation of the melanocortin system causes generalized sensitization to anorectic agents in mice. J Clin Invest. 2024, 134(14):e178250.
- 17.Deaton AM, Dubey A, Ward LD, et al. Rare loss of function variants in the hepatokine gene INHBE protect from abdominal obesity. Nat Commun. 2022, 13(1):4319.
- 18.Coassolo L, B Danneskiold-Samsøe N, et al. Prohormone cleavage prediction uncovers a non-incretin anti-obesity peptide. Nature. 2025 Mar 5. doi: 10.1038/s41586-025-08683-y.
- 19.Shi X, Hu X, Fang X, et al. A feeding-induced myokine modulates glucose homeostasis. Nat Metab. 2025 Jan;7(1):68-83. doi: 10.1038/s42255-024-01175-9. Epub 2025 Jan 2. Erratum in: Nat Metab. 2025 Feb 11. doi: 10.1038/s42255-025-01231-y.
- 20.Akbari P, Gilani A, Sosina O, et al. Sequencing of 640,000 exomes identifies GPR75 variants associated with protection from obesity. Science. 2021, 373(6550): eabf8683.
- 21.Kumagai H, Coelho AR, Wan J, et al. MOTS-c reduces myostatin and muscle atrophy signaling. Am J Physiol Endocrinol Metab. 2021, 320(4):E680-E690.
- 22.Wang YT, Zheng SY, Jiang SD, et al. Irisin in degenerative musculoskeletal diseases: Functions in system and potential in therapy. Pharmacol Res. 2024, 210:107480.
- 23.Cho H, Lai CC, Bonnavion R, et al. Endothelial insulin resistance induced by adrenomedullin mediates obesity-associated diabetes. Science. 2025, 387(6734):674-682.
- 24.Paulke NJ, Fleischhacker C, Wegener JB, et al. Dysferlin Enables Tubular Membrane Proliferation in Cardiac Hypertrophy. Circ Res. 2024, 135(5):554-574.
- 25.Hu L, Wei J, Zhang Y, et al. ANGPTL8 is a negative regulator in pathological cardiac hypertrophy. Cell Death Dis. 2022, 13(7):621.
- 26.Kiepura A, Stachyra K, Wiśniewska A, et al. The Anti-Atherosclerotic Action of FFAR4 Agonist TUG-891 in ApoE-Knockout Mice Is Associated with Increased Macrophage Polarization towards M2 Phenotype. Int J Mol Sci. 2021, 22(18):9772.
*声明:本文仅是介绍医药疾病领域研究进展或简述研究概况或分享医药相关讯息,并非也不会进行治疗或诊断方案推荐,也不对相关投资构成任何建议。



