双靶点设计:放射性核素偶联药物研发新方向
发布时间:
2024-11-01
作者:
戴秋云 博士,中晟全肽研发战略部副总级顾问
引言
放射性核素偶联药物(RDC)因疗效显著、副作用较低受到医药界广泛关注,开启了放射性核素药物用于肿瘤精准诊疗的新时代。由于肿瘤的单一靶点分布限制以及肿瘤的异质性,单靶点的RDC的诊治效果不尽人意,双靶点RDC因此应运而生,目前已成为RDC药物发展的新方向。本文总结了双靶点RDC研究进展,并简要介绍了多肽作为靶向分子的双靶点RDC的活性影响因素,供同仁参考。
放射性核素偶联药物(Radionuclide Drug Conjugates,RDC)由靶头分子(多肽、有机小分子或抗体)、连接臂(linker)、放射性络合物(或放射标记分子)三部分构成(图1),相对于一般的放射核素(如氯化锶[89Sr])或组织趋向性核素药物(如常用18F-FDG等)具有更高的靶向性。随着FDA批准诺华Lutathera (177Lu-dotatate,2018年)和Pluvicto(177Lu-PSMA-617,2022年)上市,该类药物因疗效显著、副作用较低受到医药界广泛关注,开启了放射性核素药物用于肿瘤精准诊疗的新时代。

图1. 放射性核素偶联药物结构示意图
已上市的RDC主要为靶向生长抑素受体(SSTR)及前列腺特异性抗原(PSMA)的68Ga(镓)-、177Lu(镥)-多肽偶联放射核素药物,用于神经内分泌肿瘤、去势抵抗前列腺癌的诊断及治疗。2023年,诺华的Pluvicto及Lutathera销售额分别为9.8及 6.05亿美元,2024年上半年Pluvicto销售已超过6.55亿美元,预计全年销售超过15亿美元(诺华年报)。目前,已有多个靶点的RDC,如αvβ3、GPPR、FAP、PSMA、SSTR、CA9、B7H3、CDH3等[1],正在临床试验,涉及的较常见同位素有68Ga、177Lu、18F、64Cu、90Y、111In、125I等,225Ac、212Pb、161Tb等也正在发展中。由于肿瘤单一靶点的分布限制以及肿瘤的异质性,单靶点的RDC的诊治效果不尽人意,双靶点RDC应运而生。一般而言,双靶点RDC具有对靶点更高的结合力、协同性,以及高的肿瘤摄取率和更好的抗代谢能力,目前已成为RDC药物发展的重要方向。
1、双靶点RDC的研究进展
最近几年来,多肽作为靶向分子的双靶RDC发展快,已有不少靶点用于双靶设计,如整合素αvβ3与其他靶点的组合(如FAP、GRPR、EGFR、CD13、MC1R等)、PSMA与GRPR、FAP组合以及其他双靶点组合(表1)[2-19],核素也较多,如68Ga、177Lu、18F、64Cu、90Y、111In、125I等。由于αvβ3在肿瘤新生血管及在多种肿瘤上过表达,αvβ3与其他靶点组成的双靶点RDC最多[2-12],涉及的肿瘤类型较多,已有双靶RDC进入肿瘤的诊断及治疗临床试验阶段(I-II期)。然而,目前以αvβ3为靶点之一的双靶RDC分子,单靶点的新分子较少,大多为已报道结合多肽或小分子的组合。以成纤维细胞激活蛋白FAP及胃泌素释放肽受体GRPR与其他靶点构成的双靶点RDC也有较多研究,一些也进入临床试验,用于乳腺癌、胰腺癌等的诊疗[13-19]。相对而言,以抗体作为靶头分子的双靶点RDC研究较少,涉及的靶点组合主要有EGFR/c-Met、PD-L1/PD-L2、PD1/CTLA4、PD-L1/ CTLA4、TfR/ Aβ等[20-22],由于抗体RDC的半衰期长,可能引起非特异放射副作用,主要用于肿瘤及其他疾病的诊断。
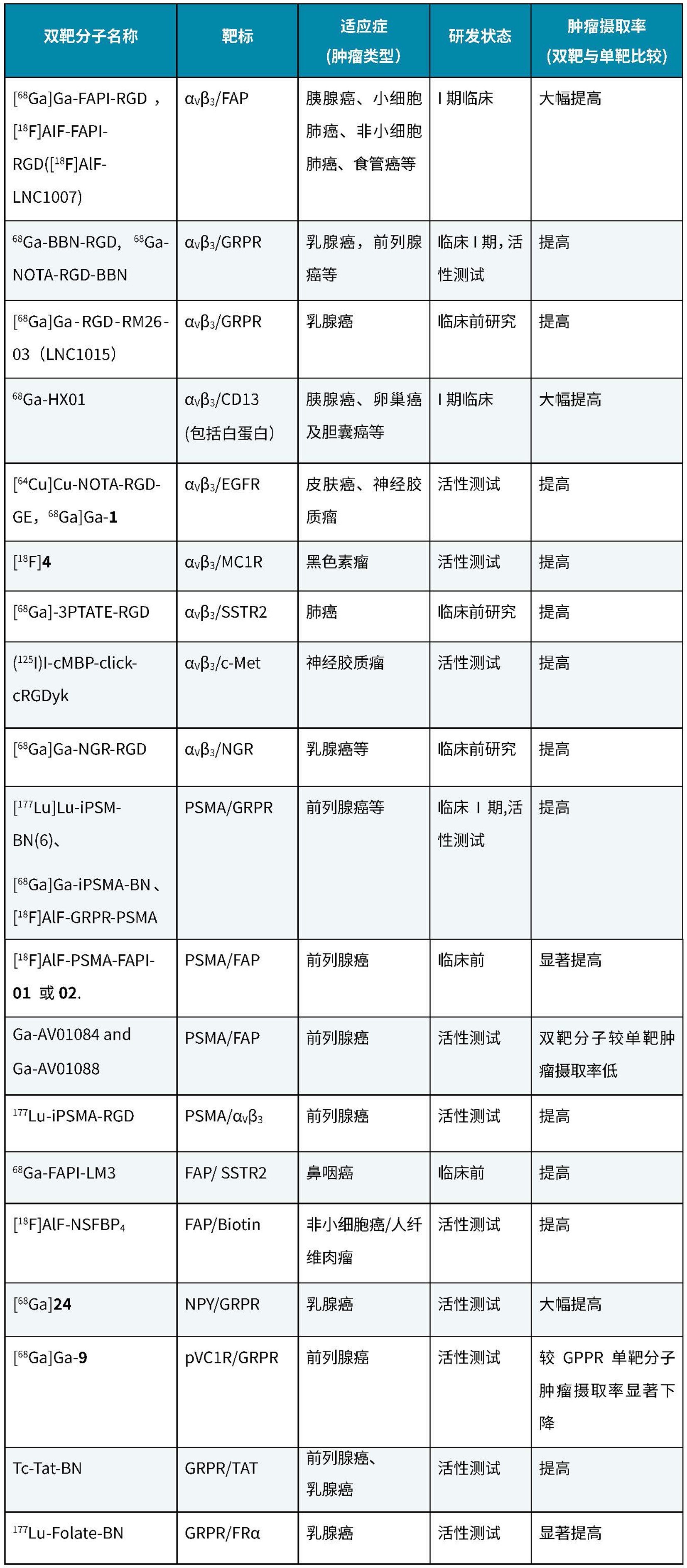
表1. 典型的多肽双靶RDC[2-19]
2、双靶点RDC活性的影响因素
双靶点RDC不是简单地将两种靶点的结合分子连接就可达到提到活性目的,需要考虑多方面因素,包括靶点的特性、靶头分子大小及linker结构等。
2.1 靶点的特性
一般而言,双靶点RDC的靶点应选择两个表达中等、表达量分布差异不太大且有互补作用的靶点。如果一个靶点表达很高,另一靶点表达很低,无法达到协同作用目的及扩展应用范围。此外,还要结合内化及肿瘤机制的不同,进行合理偏向性设计。αvβ3/FAP是一种好的靶点组合,在多种肿瘤过表达,双靶RDC [68Ga]Ga-FAPI-RGD(图2)在胰腺癌的小鼠CDX模型中显示很好的肿瘤组织摄取率(图3、4)[4-6],显著高于单靶RDC [68Ga]Ga-RGD及[68Ga]Ga-FAPI-02。在多种癌症初步的人体试验结果表明,较18F-FDG能显示更多的转移病灶(图5)[7]。
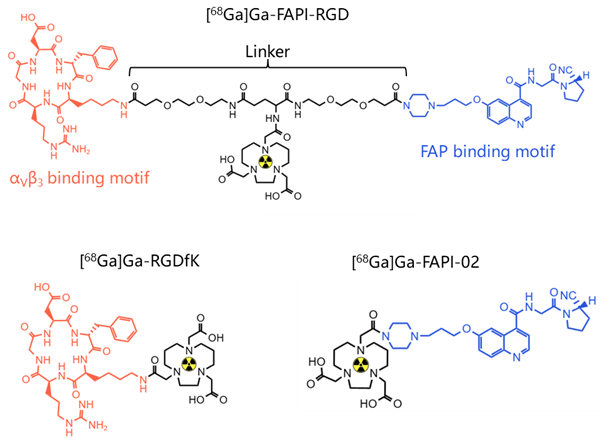
图2. αvβ3/FAP双靶点RDC [68Ga]Ga-FAPI-RGD的分子结构
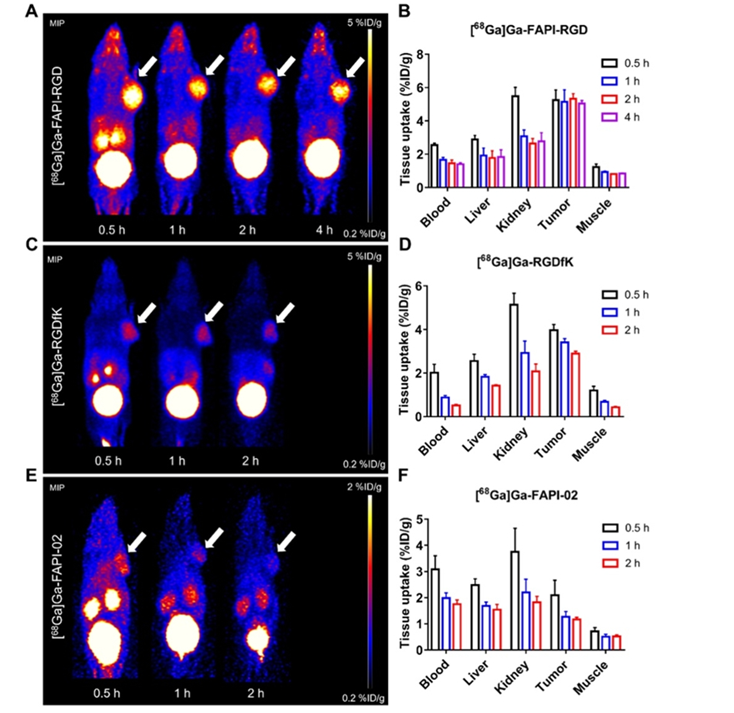
图3. αvβ3/FAP双靶点RDC与单靶RDC在胰腺癌组织的摄取比较(2h)[4]
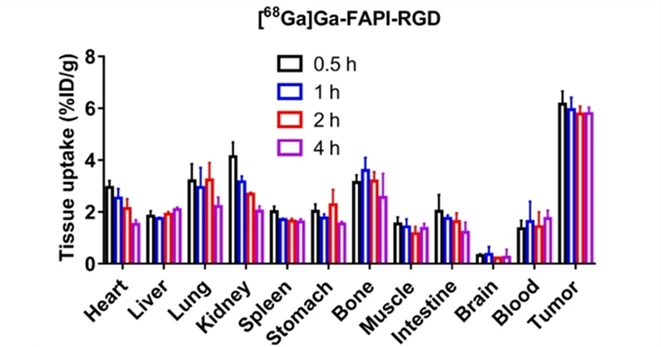
图4. αvβ3/FAP双靶点RDC在血液、肾、胰腺癌组织的摄取变化情况(4h)[4]
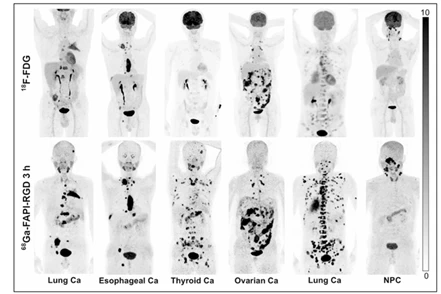
图5. αvβ3/FAP双靶点RDC[68Ga]Ga-FAPI-RGD在不同肿瘤的PET/CT图[7]
注:NPC,鼻咽癌;SCLC,小细胞肺癌;NSCLC,非小细胞肺癌;Esophageal Ca, 食管癌;Thyroid Ca, 甲状腺癌
2.2 靶头分子大小的影响
双靶分子过大影响其疏水性及活性,导致对肿瘤的特异性下降,例如作用于前列腺癌的pVC1R/GRPR双靶RDC [68Ga]Ga-9(图6),结合pVC1R受体的PACAP-27分子较大,易被肝代谢,而被加速清除,造成双靶点分子并不比单靶在肿瘤的摄取率高[19]。
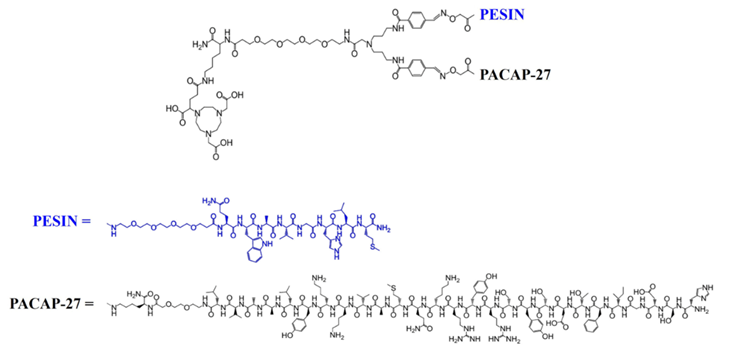
图6. pVC1R/GRPR双靶点RDC [68Ga]Ga-9的分子结构[19]
分子大小影响双靶分子活性的另一个例子是靶向前列腺癌PSMA/FAP的双靶分子AV01084及AV01088(图7)[16],该两个双靶分子比单靶分子(Ga-AV02070及Ga-PSMA -617)在肿瘤的摄取率低。可能的原因是双靶分子自身的相互作用及亲水性增加,影响其与受体FAP结合,降低了其在血液中的停留时间[16]。
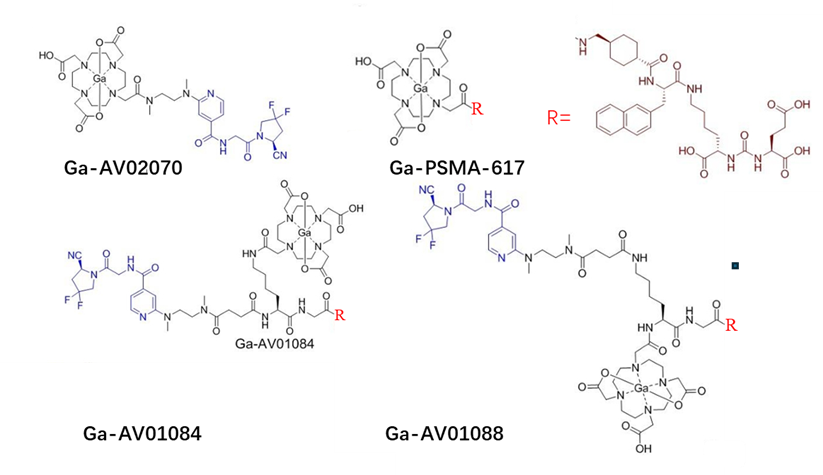
图7. PSMA/FAP双靶分子AV01084及AV01088结构[16]
2.3 Linker结构的影响
连接两个靶分子的Linker的长度及距离对活性影响显著。例如,靶向αvβ3/MC1R分子2的linker比分子4短(图8,含18F)[10],2的活性(IC50:B16F10 (0.99±0.11nM), U87MG(1300±288nM))明显高于4(IC50:B16F10(6.00±0.47nM),U87MG (2034±323 nM))[10],然而4在U87-MG肿瘤中的肿瘤摄取率高于2,在B16F10的肿瘤组织摄取相当(结果可见原文献)。此外,4比2的肾及肝吸收明显低(图9)[10],总体上说,分子4优于分子2。总之,在双靶点RDC设计中,应综合考虑靶点特性、单靶分子结构、linker长短及结构等多方面因素,方能获得效果显著提升的双靶RDC。

图8. αvβ3/MC1R双靶点[18F]2、[18F]4的分子结构
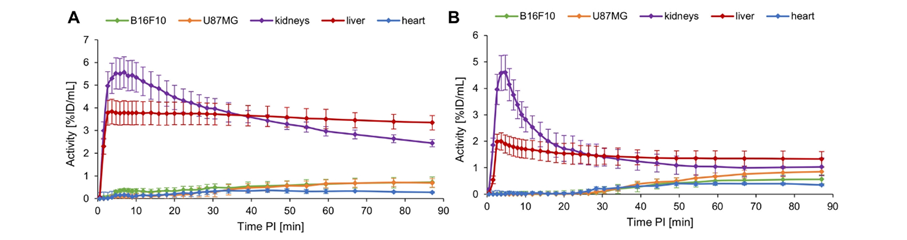
图9. αvβ3/MC1R双靶点[18F]2(A)、[18F]4(B)在黑色素瘤(B16F10)及人脑星形胶质母细胞瘤(U87MG)CDX模型组织的摄取率[10]
3、展望
双靶点RDC相较于单靶点RDC,不仅节约了用药费用,用药由两个药物变成一个,用药更方便。由于不同病人同一肿瘤的靶点异质性以及同一病人不同转移部位的肿瘤异质性,加上肿瘤发展的不同阶段及治疗用药的影响,肿瘤靶点受体的表达并不一致,双靶点RDC的互补性及协同作用可加速RDC分子内化,提高疗效、扩大人群适用范围。总的来说,目前双靶点RDC的靶点组合还较少,主要为整合素αvβ3与其他靶点的组合(如FAP、GRPR、PSMA、EGFR、c-Met、CD13、MC1R等),以及PSMA、GRPR、FAP之间的组合,靶标含有激素类受体的双靶分子占多数。此外,单靶点高效新结构结合肽比较少,且主要用于诊断,用于治疗较少。今后随着一些肿瘤特异靶点药物疗效的验证(如双抗、抗体偶联药物(ADC)等)以及靶点结合多肽的发现,双靶点的范围将显著扩容,在治疗方面也会有很大发展。预计在不久的将来,双靶点RDC将获准进入临床应用,成为RDC的主流。
参考文献
- 1. Pharmaceuticals 2023, 16, 674.https://doi.org/10.3390/ph16050674.
- 2. Juamann B, Braun D,Wängler B,et al. Current state of radiolabeled heterobivalent peptidic ligands in tumor and therapy. Pharmaceuticals(Basel). 2020,13(8):173.
- 3. Yan Q, Zhong J, Liu Y, et al. Synthesis and preclinical evaluation of a heterodimeric radioligand targeting fibroblast activation protein and integrin-αvβ3. Eur J Med Chem. 2023, 251:115279.
- 4. Zang J, Wen X, Lin R, et al. Synthesis, preclinical evaluation and radiation dosimetry of a dual targeting PET tracer [68Ga]Ga-FAPI-RGD. Theranostics. 2022, 12(16):7180-7190.
- 5. Liu N, Wan Q, Wu X, Zhao T, et al. A comparison of [18F]AlF- and 68Ga-labeled dual targeting heterodimer FAPI-RGD in malignant tumor: preclinical evaluation and pilot clinical PET/CT imaging. Eur J Nucl Med Mol Imaging. 2024, 51(6):1685-1697.
- 6.Liu K, Jiang T, Rao W, et al. Peptidic heterodimer-based radiotracer targeting fibroblast activation protein and integrin αvβ3. Eur J Nucl Med Mol Imaging. 2024, 51(6):1544-1557.
- 7. Zhao L, Wen X, Xu W, et al. Clinical evaluation of 68Ga-FAPI-RGD for imaging of fibroblast activation protein and integrin αvβ3 in various cancer types. J Nucl Med. 2023, 64(8):1210-1217.
- 8. Liu Z, Niu G, Wang F, Chen X. (68)Ga-labeled NOTA-RGD-BBN peptide for dual integrin and GRPR-targeted tumor imaging. Eur J Nucl Med Mol Imaging. 2009, 36(9):1483-94.
- 9. Braun D, Judmann B, Cheng X, et al. Synthesis,radiolabeling, and in vitro and in vivo characterization of heterobivalent peptidic agents for bispecific EGFR and integrin αvβ3 targeting. ACS Omega. 2023, 8(2):2793-2807.
- 10. Cheng X, Hübner R, von Kiedrowski V, et al. Design, synthesis, in vitro and in vivo evaluation of heterobivalent SiFAlin-modified peptidic radioligands targeting both integrin αvβ3 and the MC1 receptor-suitable for the specific visualization of melanomas? Pharmaceuticals (Basel). 2021, 14(6):547.
- 11. Liu B, Zhang Z, Wang H, Yao S. Preclinical evaluation of a dual sstr2 and integrin αvβ3-targeted heterodimer [68Ga]-NOTA-3PEG4-TATE-RGD. Bioorg Med Chem. 2019, 27(21):115094.
- 12. Trencsényi G, Halmos G, Képes Z. Radiolabeled NGR-based heterodimers for angiogenesis imaging: A review of preclinical studies. Cancers (Basel). 2023, 15(18):4459.
- 13. Liolios C, Schäfer M, Haberkorn U, et al. Novel bispecific PSMA/GRPr targeting radioligands with optimized pharmacokinetics for improved PET imaging of prostate cancer. Bioconjug Chem. 2016, 27(3):737-51.
- 14. Zhao L, Pang Y, Fang J, et L. Design, Preclinical Evaluation, and Clinical Translation of 68Ga-FAPI-LM3, a Heterobivalent molecule for PET imaging of nasopharyngeal carcinoma. J Nucl Med. 2024, 65(3):394-401.
- 15. Chen X, Xia D, Zeng X, et al. Rational design and pharmacomodulation of 18F-labeled biotin/FAPI-conjugated heterodimers. J Med Chem. 2024, 67(10):8361-8371.
- 16. Verena A, Merkens H, Chen CC, et al. Synthesis and preclinical evaluation of two Novel 68Ga-labeled bispecific PSMA/FAP-targeted tracers with 2-Nal-containing PSMA-targeted pharmacophore and pyridine-based FAP-targeted pharmacophore. Molecules. 2024, 29(4):800.
- 17. Ye S, Li H, Hu K, et al. Radiosynthesis and biological evaluation of 18F-labeled bispecific heterodimer targeted dual gastrin-releasing peptide receptor and prostate-specific membrane antigen for prostate cancer imaging. Nucl Med Commun. 2022, 43(3):323-331.
- 18. Vall-Sagarra A, Litau S, Decristoforo C, et al. Synthesis, invitro, and initial in vivo evaluation of heterobivalent peptidic ligands targeting both NPY(Y₁)- and GRP-receptors-an improvement for breast cancer imaging? Pharmaceuticals (Basel). 2018, 11(3):65.
- 19. Lindner S, Rudolf H, Palumbo G, et al. Are heterobivalent GRPR- and VPAC1R-bispecific radiopeptides suitable for efficient in vivo tumor imaging of prostate carcinomas? Bioorg Med Chem Lett. 2021, 48:128241.
- 20. Banka V, Kelleher A, Sehlin D, et al. Development of brain-penetrable antibody radioligands for in vivo PET imaging of amyloid-β and tau. Front Nucl Med. 2023, 3:1173693.
- 21. Yao Y, Ren Y, Hou X, et al.Construction and preclinical evaluation of a 124I-labelled bispecific antibody targeting PD-L1 and PD-L2. Eur J Nucl Med Mol Imaging. 2024 Aug19.
- 22. Jiang C, Tian Q, Xu X, et al. Enhanced antitumor immune responses via a new agent [131I]-labeled dual-target immunosuppressant. Eur J Nucl Med Mol Imaging. 2023, 50(2):275-286.
*声明:本文仅是介绍医药疾病领域研究进展或简述研究概况或分享医药相关讯息,并非也不会进行治疗或诊断方案推荐,也不对相关投资构成任何建议。



