《成功之路:Pluvicto™的探索与创新之旅》
发布时间:
2024-08-01
作者:
王斌 博士,中晟全肽研发战略部高级科学家
引言
2022年3月,PluvictoTM (177Lu-PSMA-617)获得FDA批准,用于治疗PSMA阳性的转移性去势抵抗性前列腺癌,成为全球首款靶向PSMA的放射性配体疗法。尽管一季度面临供应极度紧张的情况,PluvictoTM的销售额仍达到了2.11亿美元,同比增长18%。二季度,PluvictoTM继续保持增长势头,销售额达2.4亿美元,使得上半年PluvictoTM的销售总额达到4.5亿美元。到了2023年,PluvictoTM的销售总额达到9.8亿美元,同比增长261%,仅一步之遥便迈入全球药品“10亿美元俱乐部”。实际上早在2014年德国癌症研究中心已经在探索PSMA-617在核影像方面的研究。在2017年,Endocyte以1720万美元的价格从德国癌症研究中心获得177Lu-PSMA-617并开始在前列腺癌治疗领域进行进一步临床开发。随后2018年,诺华(Novartis)新任CEO Vas Narasimhan及其董事会决定以总值21亿美元(溢价54%)收购Endocyte公司,取得其最有价值的资产177Lu-PSMA-617。随着诺华PluvictoTM的成功以及国家政策的支持,目前国内也已经有很多公司参与到核药医学研发中。尽管所有的参与者都对广阔的前景充满期待,但也将面临一个重要问题:PluvictoTM取得成功的原因是什么?这种成功是否可以被复制?
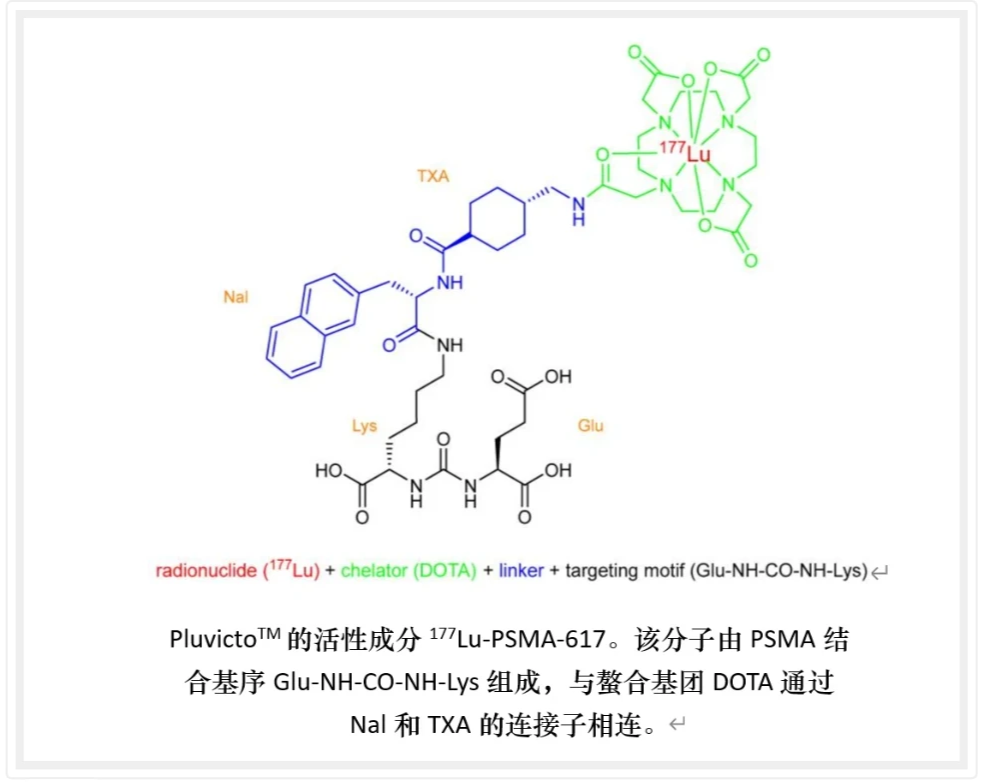
1、前列腺癌肿瘤标志PSMA
要了解针对靶向177Lu-PSMA-617的药物开发,首先要了解前列腺癌与PSMA (Prostate-specific membrane antigen) 。前列腺癌是男性最常见的恶性肿瘤之一,通常发生在前列腺腺体组织中。目前,用于前列腺癌治疗选择相对有限,主要包括手术、放疗、激素治疗等,缺乏更加个性化和靶向性的治疗方案。
PSMA是一种在前列腺组织中高表达的蛋白,被广泛用于靶向前列腺癌的诊断和治疗。它是一种跨膜糖蛋白酶, 在前列腺癌组织中的表达量比其它正常组织高出数倍至数百倍(图一),使得针对PSMA的放射性标记试剂在检测肿瘤时更为敏感。PSMA不仅在前列腺癌中有高表达,还在其他实体瘤的新生血管以及一些正常组织中存在。其在癌症晚期和抗雄激素治疗的癌细胞中表达更高,并与肿瘤的侵袭性、转移和复发相关。PSMA的生物学特性使其成为靶向放射性标记剂的理想目标,可提高成像的准确性和治疗效果。
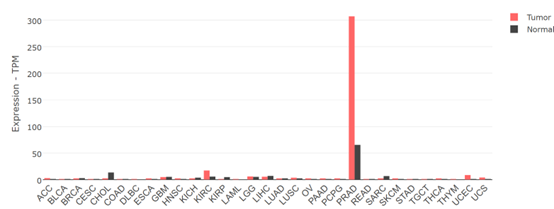
图一 PSMA在前列腺癌和正常组织中的表达差异(数据来自Gepia2)
PSMA的结构包括胞内区、跨膜区和胞外区,其中胞外区占据其大部分,是小分子和抗体作用的重要位点(图二)[1]。PSMA的独特结构特点使其成为一个潜力巨大的生物标靶,尤其在开发小分子放射性药物方面具有重要意义。通过设计不同偶联配体识别并结合到PSMA上,可以实现更好的细胞内聚集,提高成像和治疗效果。这些特征使PSMA成为了一个非常有发展潜力的生物标靶,尤其是在开发PSMA抑制剂放射性药物方面,这样的小分子药物通常具有从血液中洗脱速度快、周围正常组织摄取率低等特点[2]。
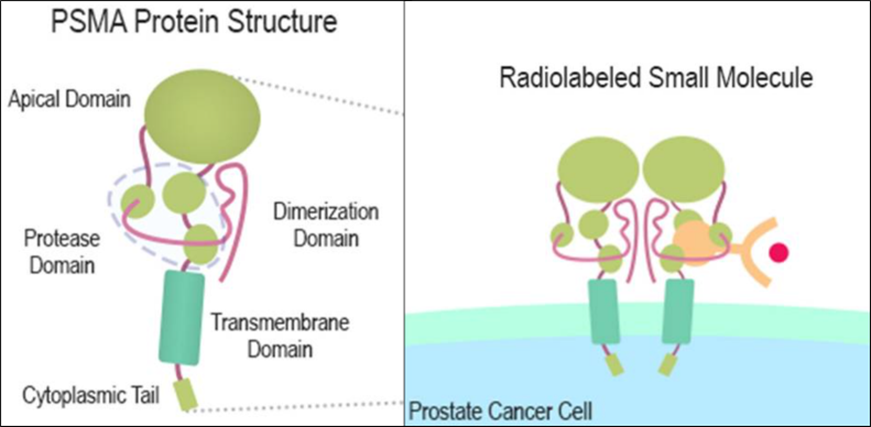
图二 PSMA蛋白结构
2、PluvictoTM的研发历程
尿素衍生物(urea derivatives)被用于靶向PSMA是一种经典且非常成功的靶向开发策略(图三)。谷氨酸尿素是PSMA的天然配体,谷氨酸尿素小分子及其衍生物(Glu-urea-R)是PMSA的叶酸水解酶I酶活性抑制剂,它能够特异地结合PSMA,并且可以内化到PSMA阳性细胞内。这些抑制剂中,带有Lys-urea-Glu骨架的小分子被发现能够特异而高效地聚集在前列腺癌细胞中。因此,一系列基于Lys-urea-Glu的PSMA靶向成像剂出现,具有良好的生物学特性,用于可视化前列腺癌病变,如DCFPyL、PSMA-1007、PSMA-11和PSMA-617等[3,4](图四)。
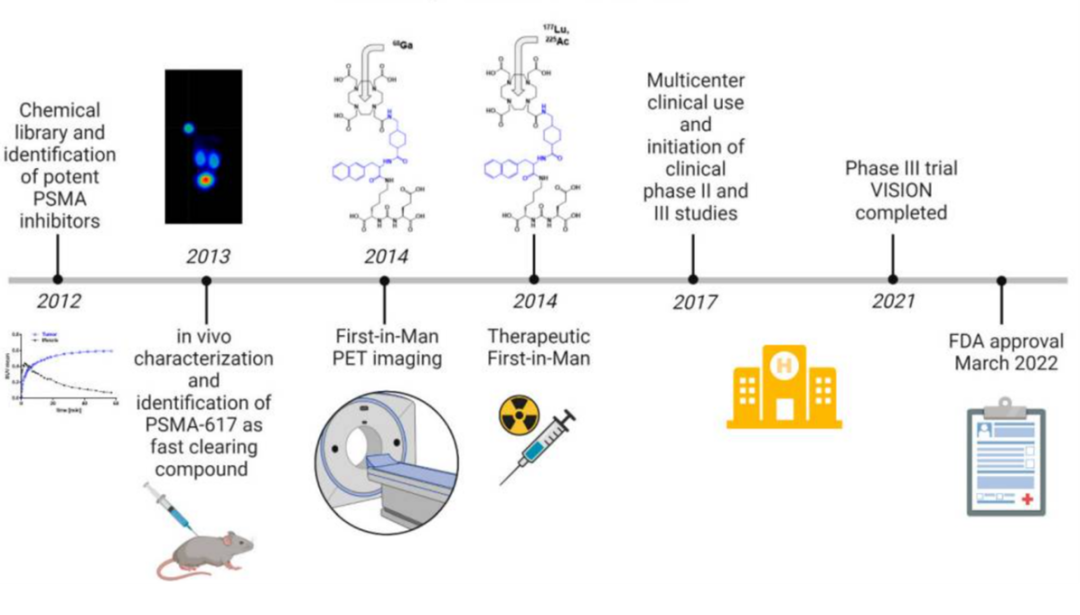
图三 PSMA- 617开发历程

图四 PSMA抑制剂分子
在2014年前后,Matthias Eder教授团队的研究表明他们通过优化PSMA-617的连接子,成功降低了其在肾脏的吸收和摄取率[5,4]。PSMA-617表现出高亲和力,经标记后在肿瘤细胞中有较高的特异内化率。药代动力学分析显示177Lu-PSMA-617注射2.5小时内在体内分布到多个组织,大部分与血浆结合,未结合物质主要经肾脏快速排泄(图五)。在注射后24小时,肾脏对177Lu-PSMA-617的摄取几乎完全清除,而肿瘤摄取量保持或略有增加,其他器官的摄取量较低(图六)。这些结果为将PSMA-617用于肿瘤治疗提供了重要的药代动力学信息和潜在应用前景。
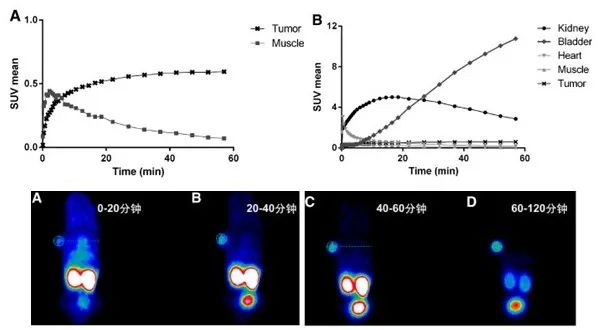
图五 PSMA-617由肾脏快速清除
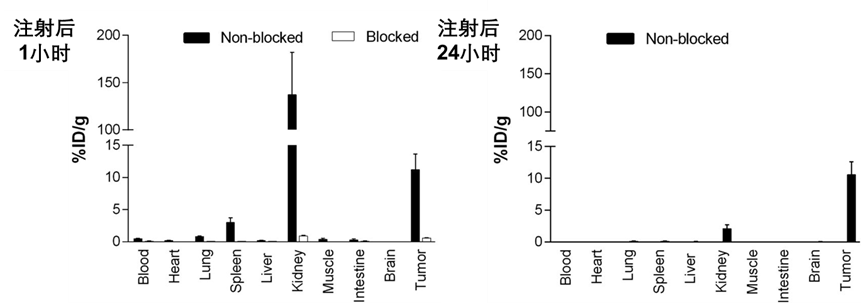
图六 PSMA-617体内药代组织分布
3、BD交易成就PluvictoTM
2014年,德国公司ABX与德国癌症研究中心联手开发了PSMA-617针对前列腺癌细胞特异性的新型药物。2017年,来自印第安纳州的Endocyte公司成功取得了PSMA-617的授权许可,这标志着一场全新的药物开发旅程的开始。Endocyte是一家专注于小分子药物偶联的公司,最初开发的产品EC145用于治疗卵巢癌,但遭遇了失败。随后,Endocyte转向PSMA-617,利用其针对前列腺癌的特异性,通过将放疗药物177Lu与PSMA-617结合来实现对癌细胞的靶向治疗。EC145选择的是卵巢癌细胞高表达的叶酸受体,PSMA-617选择的是前列腺癌细胞高表达的PSMA。EC145选择化疗药物,PSMA-617选择177Lu,杀灭癌细胞。这一药物的革新机制让Endocyte公司重新焕发活力,将发展重心重新聚焦在前列腺癌治疗领域。Endocyte并没有止步于PSMA-617的授权,而是积极投身临床试验。2017年和2018年的临床试验为这一疗法的进一步发展奠定了基础。
2017年10月,诺华公司完成对Advanced Accelerator Applications(AAA)的收购,短短一年后,AAA的LUTATHERA药物获得了FDA的批准,这标志着诺华正式踏入核药市场的大门。随后,诺华展开了核药市场的布局与拓展,完善产品线、搭建全产业链,以及进行了应用场景和客户端的培训宣传。这一连串的举措为诺华的核药事业打下了坚实的基础,后来揽入177Lu-PSMA-617也是顺理成章了。
随着对Endocyte公司的收购,诺华不仅获得了该公司,更是赢得了其珍贵资产177Lu-PSMA-617,这款小分子靶向放疗前列腺癌药物。此前,177Lu-PSMA-617在一项针对PSMA阳性晚期转移前列腺癌患者的二期临床试验中表现出色,患者的进展生存时间(PFS)为7.6个月,总生存时间(OS)为13.5个月[6]。随后,名为VISION的三期临床试验正在进行中,FDA已批准将放射进展生存(rPFS)作为代替总生存时间作为一级终点,为试验成功增添了新的可能性。随着诺华公司的介入,PluvictoTM将迎来更广阔的发展空间。
4、PluvictoTM改变转移性前列腺癌治疗格局
VISION是一项随机、多中心、开放标签III期临床试验旨在评估177Lu-PSMA-617在PSMA阳性mCRPC男性患者中的疗效的试验。患者需符合一系列入组标准,包括接受过特定药物治疗、具有PSMA阳性mCRPC等,同时还需排除一些病变特征不符合标准的患者。该研究的主要目标是评估177Lu-PSMA-617治疗对前列腺癌患者的OS和放射影像进展无病生存期(rPFS)的影响。患者接受了177Lu-PSMA-617,每6周一次,剂量为7.4 GBq (200 mCi)最多可总共接受6次剂量,同时接受最佳支持疗法(BSoC)或仅接受BSoC。若OS或rPFS(或两者)中任一指标具有统计学意义,则认为研究结果为阳性。次要终点为总体反应率(ORR)。VISION试验结果显示,在831名随机分配的患者中,177Lu-PSMA-617放射治疗2-3线前列腺癌,患者OS和rPFS明显延长,试验结果具有统计学和临床意义,死亡风险降低了38%,基于影像的疾病进展减少了60% [6](图七)。
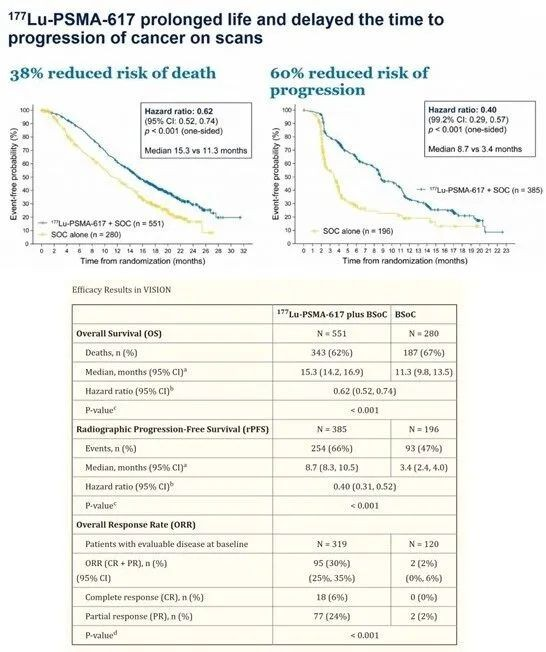
图七 VISON临床III期试验结果
在安全性方面,放射性药物疗法由于其不可避免的辐射作用,往往在放射性药物研发过程中会受到额外重视。177Lu-PSMA-617虽然血液滞留时间很短,肾脏滞留时间也较短,但是为了保证其肿瘤抑制作用(实体瘤摄取在>100Gy临床效果较明显),临床推荐使用剂量为7.4GBq(200 mci)每六周一个周期,最多6个周期,因此存在一定的3-4级的血液毒性(13%贫血症,8%血小板减少)、3%的肾脏损伤。除此之外,由于PSMA也在唾液腺细胞中表达,可以造成唾液腺细胞损伤,导致口干症[7]。 基于次试验结果,2022年03月23日PluvictoTM(177Lu-PSMA-617)获得FDA批准上市,2022年10月18日欧盟批准上市,随后在英国、瑞士、加拿大、新加坡、中国香港等国家/地区获得批准。PluvictoTM 年治疗费用最高25.5万美元,每针4.25万美元。
5、PluvictoTM前列腺癌治疗未来展望
PluvictoTM在PSMA靶向放射核素疗法在前列腺癌治疗中表现出高效性和低副作用。目前获批的适应症主要应用于代谢性去势抵抗性前列腺癌患者,这些患者在标准治疗后疾病进展,代表了一个预后较差的人群[8]。PluvictoTM未来开发方向是将适应症扩展到疾病早期阶段。目前在美国接受PluvictoTM治疗的潜在人群约为20,000名患者,现在诺华在进行一些新的III期试验,计划将PluvictoTM扩展到二线转移性去势抵抗性前列腺癌(mCRPC)( PSMAfore研究,计划在2024年下半年结束),转移性激素敏感性前列腺癌(PSMAddition研究,预计在2025年结束),寡转移性前列腺癌(正在进行第三阶段试验)等,未来PluvictoTM整体病人获益数将会增加(图八)[9]。
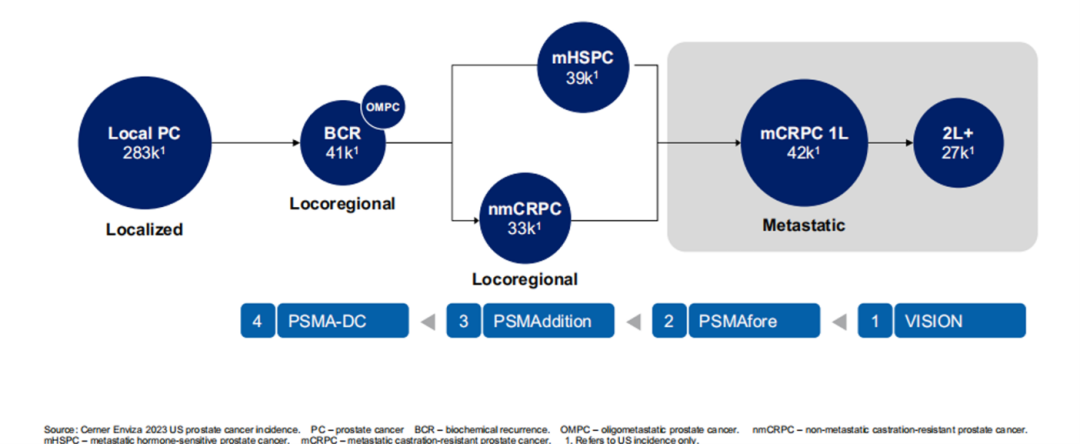
图八 PluvictoTM在前列腺癌适应症扩展进展
在2024年将有约3,700名患者接受治疗(二线及以后治疗的mCRPC患者中的渗透率约为14%),基于批发价格每剂4.5万美元、每6周给药一次、共6个周期的年度治疗费用为27万美元,PluvictoTM有望在2024年达到17亿美元的净销售额。据Evaluate提供的预测,PluvictoTM的强劲增长势头很可能在2025年及以后持续预计在2030年达到销售峰值41亿美元(图九)[9]。
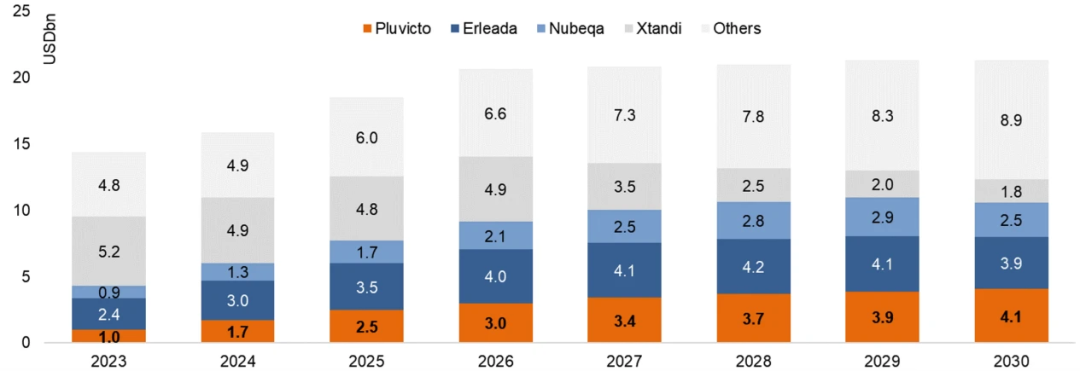
图九 PluvictoTM市场份额预测
6、成功之路我们是否可以学习借鉴
PluvictoTM的成功,不是偶然,也必然难以轻易复制。首先在RDC药物开发中,靶标的选择十分重要。PSMA在前列腺癌中高度特异性表达(>100倍)、以及可靶向性和特异性等特点,这种靶向性和特异性使得PSMA成为治疗前列腺癌的理想靶标[2]。其次,在RDC的开发和优化过程中,靶头的选择十分重要。靶头分子的分子量,选择性和亲和力决定了药物的药物动力学和药效。177Lu-DOTATATE和177Lu-PSMA均使用多肽为靶头。这些药物由于分子量较小,体内生物半衰期较短,高选择性,因此对血液和正常器官的辐射损伤相对较轻。同时,通过稳定性的优化、linker的改进、组织器官的分布和配位物的稳定性等方面的优化,也可降低药物的副作用。
在药物开发中,选择合适的放射性同位素至关重要。一些常用的放射性同位素包括177Lu、68Ga、64Cu、90Y、18F、225Ac和212Pb。其中,177Lu由于其合适的半衰期 (6.7天),适中的β粒子能量,并且可以放射γ射线,具有成像能力,非常适合靶向治疗。225Ac其α射线具有高辐射能量LET和较短的射程,近年来在治疗型RDC设计中备受关注,但目前225Ac供应受限生产仍不够成熟。总之,核素的半衰期、辐射方式和辐射量是选择适当核素的关键因素[11]。
PluvictoTM的成功案例是一个典型的由学术界多年研究最终成功商业化的范例。这一成功背后凸显了科学研究与工业界合作的重要性,以及资源整合在药物成功上市和患者受益方面的直接影响。这种跨界合作不仅加速了创新药物的研发过程,还为将科学成果转化为实际产品提供了有力支持。通过工业界的紧密合作,可以更好地整合各方专业知识和资源,推动药物研发从实验室走向市场,最终造福于患者,为医疗领域带来实质性的进步和改善。
参考文献
- 1. Eder, M., Eisenhut, M., Babich, J. & Haberkorn, U. PSMA as a target for radiolabelled small molecules. Eur J Nucl Med Mol Imaging 40, 819–823 (2013).
- 2. Hyväkkä, A. et al. More Than Meets the Eye: Scientific Rationale behind Molecular Imaging and Therapeutic Targeting of Prostate-Specific Membrane Antigen (PSMA) in Metastatic Prostate Cancer and Beyond. Cancers 13, 2244 (2021).
- 3. Kozikowski, A. P. et al. Design of Remarkably Simple, Yet Potent Urea-Based Inhibitors of Glutamate Carboxypeptidase II (NAALADase). J. Med. Chem. 44, 298–301 (2001).
- 4. Benešová, M. et al. Linker Modification Strategies To Control the Prostate-Specific Membrane Antigen (PSMA)-Targeting and Pharmacokinetic Properties of DOTA-Conjugated PSMA Inhibitors. J. Med. Chem. 59, 1761–1775 (2016).
- 5. Benešová, M. et al. Preclinical Evaluation of a Tailor-Made DOTA-Conjugated PSMA Inhibitor with Optimized Linker Moiety for Imaging and Endoradiotherapy of ProstateCancer. J Nucl Med 56, 914–920 (2015).
- 6. Fallah, J. et al. FDA Approval Summary: Lutetium Lu 177 Vipivotide Tetraxetan for Patients with Metastatic Castration-Resistant Prostate Cancer. Clinical Cancer Research 29, 1651–1657 (2023).
- 7. Hennrich, U. & Eder, M. [177Lu]Lu-PSMA-617 (PluvictoTM): The First FDA-Approved Radiotherapeutical for Treatment of Prostate Cancer. Pharmaceuticals 15, 1292 (2022).
- 8. Gillessen, S., Czernin, J. & Herrmann, K. A European Oncology Leader Looks at PSMA: A Conversation Between Silke Gillessen, Johannes Czernin, and Ken Herrmann. J Nucl Med 63, 169–171 (2022).
- 9. Chambers, C., Chitwood, B., Smith, C. J. & Miao, Y. Elevating theranostics: The emergence and promise of radiopharmaceutical cell‐targeting heterodimers in human cancers. iRADIOLOGY 2, 128–155 (2024).
- 10. Chen, J. Novartis (NVS US) (NOVN SW) – Novartis Initiation & Radiopharmaceuticals Deep-Dive. (2024).
- 11. Foss, C. A. et al. Radiolabeled Small-Molecule Ligands for Prostate-Specific Membrane Antigen: In vivo Imaging in Experimental Models of Prostate Cancer. Clinical Cancer Research 11, 4022–4028 (2005).
*声明:本文仅是介绍医药疾病领域研究进展或简述研究概况或分享医药相关讯息,并非也不会进行治疗或诊断方案推荐,也不对相关投资构成任何建议。



